|
Enzymen
Definitie:
Enzym (v. Gr. en = in, zumŤ = zuurdeeg, gist); de oude naam
voor enzym is "ferment".
( Ferment: de stof die gisting veroorzaakt =enzym; Fermentatie
= gisting ).
Op een kleine groep RNA moleculen na, zijn enzymen eiwitten
die werken als een biologische katalysator, dwz. versneller
van (bio)chemische processen die zich in levende organismen
afspelen.
( RNA: ribonucleic acid - ribonucleÔnezuur ).
Een groot deel van de kleine groep RNA moleculen ( ribozymen
of RNA enzymen) katalyseren of de eigen splitsing of de
splitsing van andere RNA's, maar ze kunnen ook de
aminotransferase-activiteit van ribosomen activeren.
Wetenschappers hebben in het laboratorium zelfs ribozymen
kunnen produceren die onder specifieke condities in staat zijn
de eigen synthese te katalyseren.
Enkele bekende ribozymen zijn: ribonuclease; groep I en
groep II introns; hammerhead, hairpin and hepatitis delta virus (HDV) ribozymes (
Human Molecular Genetics
).
Historie:
Ongeveer 10.000 voor Christus: Fermentatie; het proces dat
tot de ontdekking van enzymen leidde.
2000 voor Christus: Egyptenaren en Sumerianen ontwikkelen fermentatie voor gebruik
in brouwen, brood bakken en het maken van kaas.
800 voor Christus: de magen van kalveren en het enzym
chymosine werden gebruikt om kaas te maken.
Middeleeuwen: alchemisten identificeren alcohol als product van
fermentatie.
Alcoholische fermentatie is ontegenzeggelijk de oudste
bekendste enzym reactie. Deze en andere fenomenen werden tot
1857 gedacht spontane reacties te zijn. In 1857 concludeerde
de Franse chemicus
Louis Pasteur
dat alcoholische fermentatie wordt gekatalyseerd door
"fermenten" en alleen plaatsvindt in de aanwezigheid
van levende cellen. Vervolgens echter, ontdekte de Duitse
chemicus
Eduard Buchner
in 1897 dat een celvrij extract van gist alcoholische
fermentatie kan veroorzaken. De oude puzzel was nu
opgelost....; de gistcellen produceren het enzym en het enzym
laat de fermentatie verlopen.
|

|

|
|
Louis Pasteur
|
Eduard Buchner
|
In 1833 rapporteerde Anselme Payen samen met de chemicus en
farmacoloog Jean- FranÁois Persoz (1805 Cortaillod - 1868
Paris) de winning van een substantie uit een malt-extract
die de eigenschap bezat zetmeel om te zetten in glucose. Hij
noemde deze substantie "diastase " (α-Amylase).
Diastase was het eerste enzym dat in geconcentreerde vorm
geprepareerd werd.

Anselme Payen
De Zweedse chemicus
Jons Jakob Berzelius (1779Ė1848) verrichtte reeds in 1835 een van de eerste onderzoeken en
noemde de chemische actie van enzymen katalytisch.
Berzelius: The concept of catalysis:
"The catalytic force is reflected in the capacity that
some substances have, by their mere presence and not by their
own reactivity, to promote changes in otherwise stable and
unreactive molecules...
... in living plants and animals, thousands of catalytic
processes occur within the tissues and fluids,
generating a multitude of substances of differing chemical
compositions..."

Jons Jakob Berzelius
(1779Ė1848)
Bij zijn onderzoek naar verteringsprocessen isoleerde Theodor
Schwann in 1836 een substantie die verantwoordelijk was voor de
eiwithoudende vertering in de maag en noemde deze substantie
pepsine.
De Duitse fysioloog
Wilhelm Friedrich KŁhne (1837-1900)
vond in 1867 een substantie in pancreassap die andere
biologische substanties afbrak.
Deze substantie noemde hij "Trypsine". ( Eng:
trypsin
EC 3.4.21.4)
KŁhne stelde voor de biokatalysatoren "enzymen" te
noemen. ( De naam "ferment" en "enzym"
zijn aan gist gerelateerd).

Wilhelm Friedrich KŁhne
In 1874 vervaardigde Hansen chymosine uit de magen van kalveren
voor de productie van kaas.
In 1883 ontwikkelde Johan Kjeldahl een analytische methode om
stikstof te detecteren in bepaalde organische stoffen. Deze
methode was de basis voor de ontwikkeling van de kwantitatieve
enzymologie en algemene biotechnologie.
In dit zelfde jaar (1883) ontdekte en ontwikkelde
Emil Chr. Hansen een methode om gist
te vermeerderen, waarna het mogelijk werd gist te produceren
voor industrieel gebruik.
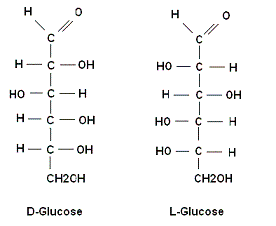
Emil Hermann Fischer, die zijn onderzoek in suikers in 1883 begon, stelde de
moleculaire structuur van fructose, glucose en vele andere
suikers vast. Tijdens zijn stereochemisch onderzoek stelde hij
vast dat er twee soorten suiker zijn: D-suikers en
L-suikers. ( D = dextro =rechts en L= Levo = links).
Hij onderzocht de reacties en de substanties die betrokken zijn
bij de fermentatie en legde tijdens zijn onderzoeken hoe enzymen
suikers afbreken de grondslag voor de enzymchemie.
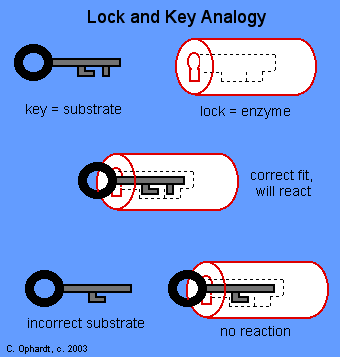
De specifieke actie van een enzym met een enkel substraat kan
worden uitgelegd volgens de "slot en sleutel" theorie.
Dit "slot en sleutel" verhaal werd voor het eerst
gepostuleerd door Fischer in 1895.
In dit verhaal is een enzym een slot en het substraat een
sleutel. Alleen de juiste sleutel (substraat) past in het juiste
slot (enzym).
( "... the intimate contact between the molecules
... is possible only with similar geometrical
configurations. To use a picture, I would say that
the enzyme and the substrate must fit together like
a lock and key."
Emil Fischer, 1895 )

Emil Hermann Fischer
(1852-1919)
Later bleek dat het slot en sleutel verhaal niet geheel correct
is. Het is nu bekend dat de actieve zijde van enzymen
vormen hebben die corresponderen met vormen van het substraat
nadat het substraat gebonden is. Men heeft een aangepaste
theorie voorgesteld: "The induced fit" theorie.
Deze theorie neemt aan dat het substraat een rol speelt bij de
uiteindelijke vorm van het enzym en dat het enzym gedeeltelijk
flexibel is en werd in 1958 beschreven door
Daniel E. Koshland Jr.
Wilhelm Ostwald
definieerde in 1893 katalysatoren en enzymen en bevestigde de
katalytische theorieŽn van Jons Jakob Berzelius.
Jokichi Takamine was de eerste persoon die een enzym uit een
microbische bron vervaardigde. Hij vervaardigde
taka-diastase uit Aspergillus ( schimmelgeslacht) als een
verteringsenzym in 1894.
In 1926 werd het eerste enzym in pure vorm verkregen. Dit feit
werd volbracht door
James B. Sumner van de
Cornell University. Sumner was in staat om het enzym
urease
uit een vrucht van de broodvruchtboom te isoleren en te
kristalliseren. Hiervoor kreeg hij in 1946 de Nobelprijs.
Sumner suggereerde, in tegenstelling tot de heersende
opvattingen, dat enzymen eiwitten zijn. De meeste critici in
die tijd geloofden dat pure enzymen geen eiwitten bevatten.
John H. Northrop en
Wendell M. Stanley van de
Rockefeller Institute for Medical Research
deelden de Nobelprijs met Sumner. Zij ontdekten een complexe
procedure om pepsine te isoleren.
Deze precipitatie techniek die bedacht is door Northrop
and Stanley werd gebruikt om verschillende enzymen te
kristalliseren.
Behalve pepsine, kristalliseerde Northrop ook
trypsine
en chymotrypsine; daarbij aantonend dat deze enzymen eiwitten
zijn.
|

|

|

|
|
James B. Sumner
|
John H. Northrop
|
Wendell M. Stanley
|
( Pepsine, een mengsel van eiwitsplitsende enzymen. Het wordt
in de maag gevormd uit het eiwit pepsinogeen. Het breekt
eiwitten af tot vrij grote peptidebrokstukken waarvan verdere
afbraak plaatsvindt in de dunne darm)
Pepsin A:
EC 3.4.23.1 ; Pepsin B:
EC 3.4.23.2 ; Pepsin C: EC 3.4.23.3
Chymotrypsin:
EC 3.4.21.1; Chymotrypsin C:
EC 3.4.21.2
Link:
The Nobel Prize in Chemistry 1946
Enzymen:
Enzymen zijn producten van de levende cel.
Het unieke van een levende cel is, dat deze in staat is een
grote verscheidenheid aan reacties met grote efficiŽntie en
specificiteit ondanks de milde fysiologische omstandigheden
(lage temperatuur neutrale pH) te laten verlopen.
De belangrijkste stoffen die zorg dragen voor de processen in de
cel zijn de enzymen. De verbindingen die door de enzymen worden
omgezet noemt men substraten.
Enzymen zijn eiwitten die door het lichaam zelf worden
aangemaakt uit deeltjes van eiwit afkomstig uit de voeding.
Meestal is een enzym een zogenaamd samengesteld eiwit, dat wil
zeggen een eiwit chemisch verbonden met een niet-eiwit, dat als
coŽnzym of als activator kan optreden.
Een enzym is een splitsings - of ontledingsstof, die een bepaald
scheikundig proces in het organisme veroorzaakt of bevordert,
zonder zelf te veranderen. Enzymen zijn biochemische
katalysatoren zonder welke een stofwisseling en spijsvertering
onmogelijk zouden zijn.
Enzymen zijn zeer specifiek. Dat wil zeggen dat voor ieder
substraat een apart enzym nodig is. Voor de werking zijn enzymen
o.a. afhankelijk van de temperatuur en de zuurgraad. De meeste
enzymen katalyseren processen met een snelheid van 1 tot 10.000
omzettingen per seconde per enzymmolecuul.
De snelheid van de enzymatische reactie neemt toe naarmate de
hoeveelheid actief enzym groter is. Door een nauwgezette
regulatie van de actieve hoeveelheid van elk enzym is de levende
cel in staat het verloop van elke reactie te reguleren en
hierdoor wordt een strakke coŲrdinatie van alle chemische
reacties mogelijk.
Aangezien vrijwel alle biologische processen (synthese, groei,
uitscheiding e.d.) door enzymen gekatalyseerd worden, worden de
fysiologische eigenschappen of het karakter van een levend
organisme (van een levende cel) bepaald door de enzymen die erin
aanwezig zijn. Dat een levercel zich blijft gedragen als een
levercel en nooit als een niercel (hoewel beide zijn ontstaan
uit ťťn enkele eicel) vloeit dus voort uit het feit dat een
levercel een bepaalde verzameling enzymen bezit en een niercel
een andere verzameling enzymen. Dat een bepaalde cel bepaalde
enzymen wel en andere niet bezit, komt doordat die cel alleen
die bepaalde enzymen kan produceren.
Enzymen en coŽnzymen hebben slechts een beperkte levensduur en
ze moeten op tijd vervangen worden. Daarom moeten er in het
dieet voldoende aminozuren, vitaminen en metaalionen aanwezig
zijn om de afgebroken enzymen en coŽnzymen tijdig te kunnen
vervangen.
Vitaminen
zijn organische moleculen die onmisbaar zijn voor de opbouw van
enzymen en coŽnzymen die niet door het organisme zelf gemaakt
kunnen worden. Daardoor is het noodzakelijk dat ze via het
voedsel worden opgenomen.
De mens heeft eveneens slechts een beperkte mogelijkheid om
essentiŽle metaalionen op te slaan, en de biologische labiliteit
van de meeste metallo-enzymen vereist dat ook deze ionen
dagelijks via ons voedsel worden opgenomen.
Werking:
Voor de werking van de enzymen is het interne milieu van de
levende cel niet vereist. Ze kunnen dus na verbreking van de
celstructuur worden geÔsoleerd en gezuiverd en in de
reageerbuis (in vitro) worden bestudeerd. Hieruit blijkt dat
de katalytische eigenschappen van de enzymen verankerd zijn in
hun structuur.
Het is gebleken dat het overgrote deel van de enzymen behoort
tot de eiwitten. Dankzij de sterk toegenomen kennis van de
eiwitstructuur is het mogelijk geworden de uitzonderlijke
eigenschappen van de enzymen te verklaren en te voorspellen.
Een eiwit blijkt te zijn opgebouwd uit een groot aantal
verschillende bouwstenen (aminozuren), die in een vaste,
specifieke volgorde aaneengeregen zijn. De specifieke volgorde
van de aminozuren in de eiwitketen is bepalend voor de wijze
waarop de ketens bij gegeven pH e.d. ruimtelijk worden
opgevouwen. Uitsluitend aan de aldus voorgeschreven
ruimtelijke structuur danken de enzymen hun specifieke
eigenschappen. Verlies van deze ruimtelijke structuur
(denaturatie) leidt dan ook tot activiteitsverlies.
Een enzym gaat met de om te zetten verbinding (het substraat)
een complex aan, dat na afloop van de reactie weer uiteenvalt
in product en onveranderd enzym. De binding van het substraat
vindt plaats aan ťťn bepaalde plek op het ruimtelijk
eiwitbouwsel, het actieve centrum. De rangschikking van de
aminozuren in en rondom dit actieve centrum is
verantwoordelijk voor het katalytisch effect en de goede
rangschikking van de bij de activiteit betrokken aminozuren is
alleen bij de ene, unieke ruimtelijke eiwitstructuur
gerealiseerd.
De ruimtelijke
opvouwing
van een eiwitketen is onder meer afhankelijk van de pH
(zuurgraad) en dit verklaart de sterke pH-afhankelijkheid van
de enzymatische activiteit. De meeste enzymen zijn slechts in
een zeer beperkt pH-gebied optimaal actief (het optimum ligt
doorgaans bij pH 5Ė8). Buiten dit pH-gebied verliezen de
enzymen, soms op irreversibele wijze, hun activiteit.
In vele gevallen kan de katalytische werking van de enzymen
worden verhoogd door bepaalde stoffen, die activatoren worden
genoemd. Voorbeelden hiervan zijn thiolverbindingen (zoals
mercapto-ethanol en cysteÔne), maar ook tweewaardige
metaalionen (Mg2+, Mn2+, Zn 2+ e.d.). Daarnaast zijn er
stoffen die de activiteit van de enzymen al of niet reversibel
verlagen (inhibitoren of remmers).
Allostere enzymen zijn enzymen waarvan de katalytische
activiteit specifiek beÔnvloedbaar is door bepaalde
metabolieten. Deze laatste binden op een andere plaats dan het
om te zetten molecuul van het enzym. Zij veranderen de
structuur van het enzym zodanig dat de activiteit ůf geremd,
ůf gestimuleerd wordt; deze invloed op de enzymactiviteit
noemt men een allosterisch effect. Zo kunnen
stofwisselingprocessen gereguleerd worden. Heel vaak wordt de
activiteit van het eerste enzym uit een reactieketen
allosterisch geremd door het eindproduct van de reactieketen
(negatieve terugkoppeling). Zo stapelt het eindproduct zich
niet op (zie ook, Pasteureffect). Met de ontdekking van de
allosterische remming van enzymen (1963) zijn de namen van de
Franse Nobelprijswinnaars Changeux,
Jacques Monod en
FranÁois Jacob
onlosmakelijk verbonden.
Er bestaan ook enzymen die in meer dan ťťn structurele vorm
voorkomen in ťťn en hetzelfde (hogere) organisme en toch
dezelfde reactie katalyseren, zogeheten iso-enzymen. Een goed
onderzocht voorbeeld is dat van melkzuurdehydrogenase, waarvan
in totaal vijf verschillende vormen (iso-enzymen) voorkomen.
Er zijn kleine enzymatische verschillen tussen de vormen die
in de hartspier, de lever en de longen voorkomen; deze vormen
beantwoorden echter aan de zeer verschillende fysiologische
eisen die aan deze drie organen worden gesteld.
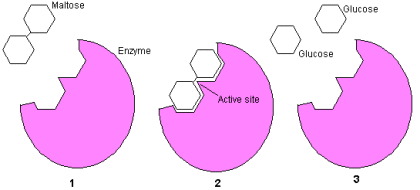
Maltose bestaat uit twee aan elkaar gebonden glucose
moleculen (1).
Het enzym Maltase ( Alpha-glucosidase
) is een proteÔne die precies zo gevormd is dat het
een maltose molecuul kan accepteren en de binding
kan verbreken.(2).
Twee glucose moleculen blijven over (3).
Een enkel maltase enzym kan tot 1000 maltose bindingen
per seconde verbreken en accepteert alleen maltose
moleculen.
Alpha-glucosidase (
EC 3.2.1.20
)
Human genetic disease: Glycogen storage disease II (GSD II) (
Ziekte van Pompe )
OMIM:
232300
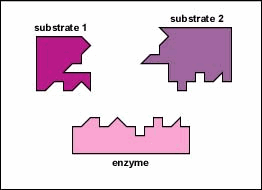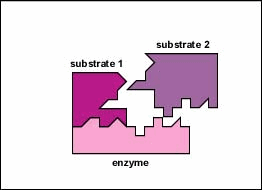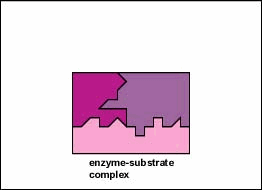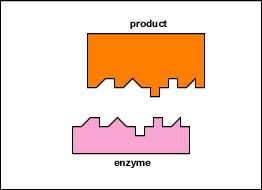
In de meeste chemische reacties bestaat een energiebarriŤre
die overwonnen moet worden voordat de reactie plaats kan
vinden. Deze barriŤre voorkomt dat complexe moleculen zoals
proteÔnen en nucleÔnezuren spontaan afgebroken worden en is
dus nodig voor het in stand houden van het leven.
Wanneer er echter in de cel bepaalde metabole veranderingen
vereist zijn, zullen bepaalde van deze complexe moleculen
afgebroken moeten worden en zal de energiebarriŤre overwonnen
moeten worden.
Warmte zou de extra benodigde energie kunnen leveren (
activatie-energie genoemd ), maar de toename in temperatuur
zou de cel vernietigen. Het alternatief is de verlaging van de
activatie-energie spiegel door het gebruik van een
katalysator. Dit is dan ook de rol die enzymen spelen. Zij
reageren met het substraat waarbij een overgangscomplex wordt
gevormd die minder energie vereist om de reactie te laten
verlopen. Het onstabiele tussenproduct zal snel worden
afgebroken tot de reactieproducten en het onveranderde enzym
is vrij te reageren met andere substraat moleculen.
Alleen een bepaald gebied van het enzym, de actieve
zijde genoemd, zal aan het substraat binden. Deze actieve
zijde is een gleuf of holte die gevormd wordt door het
driedimensionale vouwpatroon van de proteÔne. Deze
driedimensionale structuur, tezamen met de chemische en
elektrische eigenschappen van de aminozuren in de actieve
zijde, staan alleen bepaalde substraten toe te binden aan deze
zijde, aldus de specificiteit van het enzym bepalend.
De synthese en de activiteit van enzymen kan worden
beÔnvloed door genetische controle en de verdeling in de cel.
Sommige enzymen worden niet geproduceerd door bepaalde cellen
en andere worden alleen gevormd wanneer zij nodig zijn.
Enzymen worden niet altijd uniform in een cel gevonden; vaak
worden zij verdeeld in de nucleus, op het celmembraan of in
subcellulaire structuren. De snelheid van de enzym synthese en
de activiteit wordt verder beÔnvloed door hormonen,
neurosecreties en andere chemische stoffen die het interne
milieu van de cel beÔnvloeden.
Omdat enzymen niet verbruikt worden in de reacties die
zij katalyseren en steeds weer opnieuw gebruikt kunnen worden,
is alleen een zeer kleine hoeveelheid van een enzym nodig om
een reactie te katalyseren. Een typisch enzymmolecuul kan 1000
substraat moleculen per seconde omzetten. De snelheid van de
enzymatische reactie neemt toe met een toenemende substraat
concentratie, waarbij de maximale snelheid wordt bereikt
wanneer alle actieve zijden van de enzymmoleculen zijn bezet.
Het enzym is dan verzadigd waarbij de snelheid van de reactie
wordt bepaald door de snelheid waarmee de actieve zijde het
substraat in product kan omzetten.
De activiteit van enzymen kan op verschillende manieren
geremd worden. Competitieve remming vindt plaats wanneer
moleculen die veel op de substraatmoleculen lijken, zich aan
de actieve zijde binden en zo voorkomen dat het eigenlijke
substraat zich aan de actieve zijde bindt. Penicilline is een
competitieve remmer die de actieve zijde van een enzym
blokkeert die vele bacteriŽn gebruiken om hun celwand op
te bouwen.
Niet competitieve remming vindt plaats wanneer een
remmer zich aan een enzym bindt op een locatie anders dan de
actieve zijde. In sommige gevallen van niet-competitieve
remming denkt men dat de inhibitor zich op zoín wijze aan het
enzym bindt dat de normale actieve zijde geblokkeerd wordt. In
andere gevallen denkt men dat de binding van de inhibitor de
driedimensionale vorm van het enzym verandert en zo de
actieve zijde vervormt waardoor er geen reactie met het
substraat kan plaatsvinden. De laatste vorm wordt
allosterische remming genoemd; de plaats waar de inhibitor aan
het enzym bindt, wordt de allosterische zijde genoemd. Vaak
zal het eindproduct van een metabole route dienen als een
allosterische inhibitor op een eerder enzym in de route. De
remming van een enzym door een product van zijn eigen metabole
route is een vorm negatieve feedback.
Allosterische controle kan zowel betrekking hebben op de
stimulatie van de enzym actie als ook de remming. Een
activatormolecuul kan aan de allosterische zijde gebonden
worden en een reactie uitlokken aan de actieve zijde door de
driedimensionale vorm van de actieve zijde te veranderen
waarna er een substraat past die deze vormverandering zelf
niet kan uitvoeren. Dit is de basis van de zogenoemde ďinduced fitĒ theorie die
stelt dat de binding van een substraat of sommige andere
moleculen aan een enzym een verandering in de
driedimensionale vorm veroorzaakt waarbij de activiteit
verbeterd of geremd wordt.
Algemene activators omvatten hormonen en de producten van
eerdere enzymatische reacties. Allosterische stimulatie en
remming staan de productie van energie en materialen door de
cel toe wanneer zij nodig zijn en remmen de productie wanneer
de toevoer voldoende is.
Enzymstructuur:
De molecuulmassa en de structuur van enzymen kan zeer variŽren.
Ribonuclease, een enzym dat nucleÔnezuren hydrolyseert die een
ribose-ring bevatten, is bijvoorbeeld een relatief klein eiwit
met een molecuulmassa van 13 700 u. Het bestaat uit 1 enkele
polypeptideketen van 124 aminozuureenheden.
In tegenstelling hiermee staat de ingewikkelde structuur van het
enzym aldolase dat betrokken is bij het glucosemetabolisme.
Dit enzym heeft een molecuulmassa van 156 000 u en bestaat uit
vier subeenheden met elk een molecuulmassa van ongeveer 40 000
u.
De polypeptideketens van leveraldolase hebben daarbij ook nog
een andere primaire structuur dan de polypeptiden van dit enzym
in de spieren.
Het macromoleculaire complex van pyruvaatdehydrogenase is zelfs
nog groter. Dit enzym katalyseert de belangrijke omzetting van
pyruvaat naar acetylcoŽnzym A.
Pyruvaatdehydrogenase is een multi-enzymcomplex waarbinnen de
verschillende componenten zo sterk aan elkaar verbonden zijn dat
het systeem als geheel geÔsoleerd kan worden uit verschillende
weefsels.
Het complex dat uit varkenshart geÔsoleerd wordt, heeft een
molecuulmassa van ongeveer 10 000 000 u en bevat 42
verschillende polypeptiden en co-factoren, die allen nodig zijn
voor de biologische activiteit.
Enzymcofactoren:
Naast het polypeptidegedeelte hebben veel enzymen nog een
niet-proteÔnecomponent nodig om hun werking te kunnen
uitoefenen.
Deze component wordt een cofactor genoemd. Wanneer een
cofactor nodig is, wordt het eiwitgedeelte het apoŽnzym genoemd.
De cofactor kan een metaalion zijn dat complex aan het enzym
gebonden is. Deze wordt dan de metaalionactivator genoemd.
Enkele voorbeelden van enzymen die een metaal-ion nodig
hebben:
|
Metaal
|
Enzym |
| Na |
sucrose
α-D-glucohydrolase
|
| K |
pyruvate kinase ( vereist tevens Mg)
|
| Mg |
Kinases ( bijv. hexokinase, pyruvate kinase);
adenosinetriphosphatases ( bijv. myosin
adenosinetriphosphatase)
|
| Fe |
Catalase, peroxidase, nitrogenase
|
| Zn |
alcohol dehydrogenase, carboxypeptidase, carbonic
anhydrase
|
| Mo |
Xanthine oxidase, nitrogenase
|
| Cu |
cytochrome c oxidase, amine oxidase
|
| Ni |
urease, hydrogenase, superoxide dismutase
|
| Mn |
histidine ammonia lyase |
| V |
nitrogenase |
Veel enzymen hebben een organisch reagens nodig om de omzetting
van substraat naar product tot stand te brengen. Dit kan een
verbinding zijn die bijvoorbeeld een hydride-ion, een
methylgroep, of een acetylgroep overdraagt naar het substraat.
Dergelijke organische verbindingen die in vergelijking met het
enzym relatief klein zijn , worden
coŽnzymen genoemd. Er zijn coŽnzymen voor oxidatie, reductie,
alkylering, acylering, isomerisatie, decarboxylering enz.
Oxidatie is het proces waarbij elektronen worden afgestaan.
Reductie is het proces waarbij elektronen worden opgenomen.
Acylering is het proces waarbij aan een molecuul een vetzuur
wordt gekoppeld.
Isomerisatie is het ontstaan van stoffen met dezelfde
molekuulformule, maar met verschillende structuurformules.
Decarboxylering is het proces waarbij uit een verbinding de
carboxylaatgroep verwijderd wordt.
Alkylering is het proces waarbij aan een organische verbinding
een alkyl groep wordt toegevoegd.
Een coŽnzym zelf is niet specifiek voor een bepaald substraat.
Het is de combinatie enzym-coŽnzym die de specificiteit bepaald.
Als een cofactor stevig aan het enzym gebonden zit door middel
van covalente of coŲrdinatieverbindingen, dan wordt de cofactor
een prosthetische groep genoemd.
Sommige coŽnzymen zitten stevig gebonden aan het enzym als
prosthetische groep, andere komen vrij voor en kunnen door
verschillende enzymen gebruikt worden.
De heemgroep is een bekend voorbeeld van een prosthetische groep
en is onder meer gebonden aan de cytochromen en aan hemoglobine.
Nomenclatuur en indeling van enzymen:
Enzymen worden meestal benoemd naar het proces dat zij
katalyseren, gevolgd door de uitgang Ėase.
Men kan de enzymen op grond van hun werking indelen in zes
hoofdgroepen:
-
Oxidoreductasen
-
Transferasen
-
Hydrolasen
-
Lyasen
-
Isomerasen
-
Ligasen
Oxidoreductasen:
Deze enzymen katalyseren redoxprocessen.
Redoxprocessen zijn processen waarbij door
elektronenoverdracht ťťn van de atoomsoorten wordt geoxideerd en
een ander gereduceerd.
Oxidatie is het proces waarbij
elektronen worden afgestaan en reductie is het proces waarbij
elektronen worden opgenomen.
Tot de groep
oxidoreductasen behoren de hydrogenasen, oxidasenreductasen,
transhydrogenasen en hydroxylasen.
CoŽnzymen die bij
deze groep enzymen veel voorkomen zijn NAD+ en FAD.
Transferasen:
Deze enzymen katalyseren groepsoverdrachtsreacties zoals
methyl-, carboxyl-, acyl-, amino- of
fosfaatgroepsoverdracht.
Tot deze groep behoren
onder meer de transfosfatasen ( kinasen ) en de
transaminasen.
Een coŽnzym dat bij de laatst genoemde een rol speelt is
pyridoxaalfosfaat.
Hydrolasen:
Deze enzymen katalyseren hydrolysereacties.
Hydrolyse
is een splitsing van scheikundige verbindingen onder opneming
van water.
Tot deze groep behoren de peptidasen,
esterasen, glycosidasen en de fosfatasen.
Een coŽnzym is niet nodig omdat water het reagens is.
Lyasen:
Deze enzymen katalyseren de splitsing van
koolstof-koolstof ( C-C ), koolstof-zuurstof ( C-O ) en
koolstof-stikstof ( C-N ) bindingen door middel van
eliminatiereacties.
Tot deze groep behoren de
decarboxylasen en de dehydratasen.
CoŽnzymen die
behulpzaam zijn bij deze categorie enzymen zijn onder meer
CoŽnzym A en thiaminepyrofosfaat.
Isomerasen:
Deze enzymen katalyseren isomerisatiereacties.
Isomeren
zijn stoffen met dezelfde molekuulformule, maar met
verschillende structuurformules.
Tot deze groep
behoren de racemasen en de epimerasen.
-
Fosfohexose-isomerase
(Glucose-6-phosphate
isomerase)
EC 5.3.1.9 dat in de glycolyse de omzetting van glucose-6-fosfaat in
fructose-6-fosfaat katalyseert, is een voorbeeld uit deze
groep.
Dit enzym katalyseert de reactie:
D-glucose 6-phosphate <=> D-fructose 6-phosphate
Human genetic disease:
Glucose-6-phosphate isomerase deficiency
OMIM:
Hemolytic anemia due to phosphoglucose isomerase
deficiency
Ligasen :
deze enzymen katalyseren de koppeling van twee
substraten waarbij een binding van een koolstofatoom met een
zuurstof-, stikstof-, zwavel- of een ander atoom gevormd
wordt.
De energie die voor de bindingsvorming nodig
is wordt meestal geleverd door hydrolyse van ATP.
Tot deze groep behoren de synthetasen en de carboxylasen.
CoŽnzymen die bij deze categorie enzymen voorkomen
zijn coŽnzym A en biotine.
Binnen deze hoofdgroepen vindt naar soort substraat
of reactietype nog een verdere onderverdeling plaats in
subgroepen en sub-subgroepen, waarbinnen de afzonderlijke
enzymen genummerd worden.
Elke groep heeft een eigen
codecijfer waardoor men de enzymen kan indelen door middel van
een vierdelig codenummer. ( het enzym classificatienummer of EC
nummer).
Elk volgend cijfer van het nummer geeft dus een meer
gedetailleerde onderverdeling en op deze wijze is naast de
triviale naam en de systematische naam nog een derde aanduiding
voor een enzym mogelijk.
De systematische naam van
bijvoorbeeld lactaatdehydrogenase ( triviale naam )
is L-lactaat-NAD-oxidoreductase en het codenummer is EC
1.1.1.27.
( EC 1.1.1.27 )
Klinische enzymologie
|
Dr J. Kortleven
Enzymen en enzyme-eenheden
Enzymen zijn katalysatoren: zij katalyseren de
omvorming van een substantie (het substraat) in een
andere (het product).
De concentraties van enzymen in het serum zijn te klein
om bepaald te kunnen worden, en we moeten ons dan ook
tevreden stellen met het meten van de activiteit van het
enzyme, bepaald uit de snelheid van het verdwijnen van
het substraat of het verschijnen van het produkt. We
meten dus enzyme-activiteit. Enzyme-activiteit
wordt uitgedrukt in internationale eenheden (I.U. =
International Unit). 1 IU is de enzyme-activiteit
waardoor 1 micromol substraat per minuut wordt
omgezet.
De hoeveelheid omgezet substraat hangt af van de
temperatuur, de pH, het type en de concentratie van het
substraat. Normale waarden verschillen dan ook van labo
tot labo.
Er is een zekere tendens om alle gemeten grootheden uit
te drukken in SI-eenheden (SystŤme Internationale). Dan
worden er geen mU/ml meer gebruikt maar katal/liter.
Verhoogde enzyme-activiteit
Enzyme-activiteit is in het algemeen hoog in cellen,
laag in serum. Normale serum enzyme-activiteit is het
gevolg van een voortdurend "uitzweten" van
enzymen uit cellen en van een natuurlijke afbraak van
cellen. (Enkele enzymen komen vooral of uitsluitend in
serum of plasma voor (pseudocholinesterase, enzymen van
de bloedstolling), of worden door exocriene klieren
uitgescheiden (amylase, lipase)).
In de cellen komen de enzymen vrij voor, of gebonden
aan intracellulaire organellen (microsomen,
mitochondriŽn). De instandhouding van de cel vraagt een
voortdurende metabole inspanning. Wanneer een cel
beschadigd wordt of aan zuurstofgebrek lijdt breekt de
celmembraan, en lekken intracellulaire bestanddelen het
serum in. Ernstige letsels, die tot celdood leiden
beschadigen ook de mitochondriŽn, en veroorzaken een
vrijkomen van de mitochondriŽle enzymen.
Het stijgen van de serumenzymen kan ook voorkomen
zonder celbeschadiging: gestegen aanmaak in de cel zal
ook een stijging van het uitlekken uit de cel
veroorzaken. Dit is het geval bij alcoholgebruik,
cholestase, sommige anticonvulsiva. Hierbij ziet men de
alkalische fosfatasen en de gamma-glutamyltransferase
stijgen, zowel in de levercellen als in het serum.
Enzymen die vrijkomen in het bloed worden zeer vlug
geÔnactiveerd en opgenomen in het reticuloŽndotheliaal
stelsel.
|
Halfwaardetijd van enkele enzymen
|
| GOT |
17 Ī 5 uren
|
| GPT |
47 Ī 10 uren
|
|
LDH1 (HBDH)
|
113 Ī 60 uren
|
| LDH5 |
10 Ī 2 uren
|
| CPK |
Ī 15 uren
|
| ALP |
3 tot 7 dagen
|
| GGT |
3 tot 4 dagen
|
| CHE |
Ī 10 uren
|
|
Amylase
|
3 tot 6 uren
|
|
Lipase
|
|
Staalname
Enzymen kunnen bepaald worden in serum, plasma, of
andere lichaamsvochten. De meeste anticoagulantia
inhiberen in meerdere of mindere mate sommige enzymen,
en men verkiest dan ook meestal de dosering uit te
voeren op serum.
Enzymen zijn in hoge concentratie aanwezig in de
cellen, ook in de rode bloedcellen, en het is dus
uiterst belangrijk hemolyse te vermijden. Vooral LDH
stijgt sterk bij hemolyse.
Over het algemeen zijn enzymen stabiel in serum
(afgescheiden van RBC) gedurende 24 uur op
kamertemperatuur, vijf dagen in de koelkast, 2 tot 3
maanden in de diepvriezer.
Natuurlijk bestaan er uitzonderingen op deze regel:
zure fosfatasen verminderen zeer sterk tenzij men het
serum aanzuurt of in contact laat met de bloedklonter.
Stalen voor LDH-isoŽnzymen moeten op kamertemperatuur
bewaard worden: LDH5 wordt gedenatureerd bij koelkast of
diepvries temperatuur.
PatiŽnten-variabelen
-
leeftijd en geslacht: zijn belangrijk bij de
bepaling van alkalische fosfatasen: de waarden zijn
verhoogd zolang er actieve beenaanmaak gebeurt. Na de
leeftijd van 60 jaar stijgen de waarden, mťťr bij
vrouwen dan bij mannen.
-
inspanning: spierinspanningen, vooral bij
ongeoefende personen veroorzaken een stijging van LDH
en GOT en hebben een massieve stijging van CPK-waarden
tot gevolg. Zelfs lichte spieroefening of
intramusculaire inspuitingen lokken verhoogde
CPK-waarden uit.
-
medicatie: anticonvulsiva en alcoholgebruik
verhogen de GGT en ALP-waarden. Ook andere waarden
kunnen interfereren. Er bestaan lijsten met mogelijke
interferenties.
-
voedselinname: in principe wordt bloed voor
enzyme-bepalingen nuchter afgenomen. Dit is niet
steeds mogelijk. Alkalische fosfatasen kunnen na
voedselinname verhoogd zijn bij sommige patiŽnten.
Enzyme-testen als hulpmiddel bij diagnose
De concentratie van enzymen in cellen is veel hoger dan
in serum, en het is dan ook begrijpelijk dat enzymtesten
zeer gevoelige indicatoren zijn voor celletsels. Men mag
rekenen dat enzymtesten een gevoeligheid hebben van mťťr
dan 90%: dit betekent dat er zeer weinig vals-negatieve
uitslagen zijn (een negatieve uitslag sluit ziekte
uit).
Enzymtesten missen echter specificiteit: abnormale
resultaten zijn dikwijls vals-positief, vooral als de
prevalentie van de ziekte laag is.
De specificiteit kan verhoogd worden door het bepalen
van isoŽnzymen: bij verschillende enzymen is de totale
activiteit de som van de activiteit van meerdere
fracties, die verschillen in fysico-chemische
eigenschappen. Zeer dikwijls is een bepaalde fractie
orgaan-specifiek. Het bepalen van de isoŽnzym-activiteit
van LDH, CPK en ALP is klinisch zinvol.
|
Relatieve concentratie van enzymen intra- en
extra-cellulair
|
| |
Serum
|
RBC
|
Lever
|
Hart
|
Spier
|
|
ASAT (SGOT)
|
1 |
x 15
|
x 7.000
|
x 8.000
|
x 5.000
|
|
ALAT (SGPT)
|
1 |
x 7 |
x 3.000
|
x 400
|
x 300
|
| LDH |
1 |
x 300
|
x 1.500
|
x 1.000
|
x 700
|
| CPK |
1 |
x 0,1
|
x 0,01
|
x10.000
|
x 50.000
|
De verschillende enzymes komen ook in andere
hoofdstukken ter sprake, zoals in "Laboratiumtesten voor het onderzoeken van de
lever".
Bespreking van enkele serumenzymen
-
Transaminasen (GOT
of ASAT : glutamaat oxaalacetaat transaminase of
aspartaat aminotransferase en
GPT
of ALAT : alanine amino-transferase of glutamaat
pyruvaattransferase).
GOT komt vooral voor in hart en lever, minder in de
gestreepte spieren, nieren en pancreas. Het bevindt zich
zowel in het cytoplasma als in de mitochondriŽn.
GPT komt vooral in de lever voor, minder in de nieren
en de skelet-spieren. Het bevindt zich vooral in het
cytoplasma.
De lever bevat ongeveer driemaal zoveel GOT als GPT.
Bij lichte leverbeschadiging zal vooral GPT vrijkomen en
de waarden van GPT liggen dan hoger dan die voor GOT.
Bij ernstige leverbeschadiging (met celnecrose) zal ook
mitochondriaal GOT vrijkomen, en zal de GOT-waarde de
GPT-waarde overtreffen. De verhouding tussen deze twee
enzymen (De Ritis quotiŽnt = GOT/GPT) is dus een maat
voor de ernst van de celbeschadiging.
Klinisch nut:
-
myocardinfarct: na myocardinfarct (6 tot 10
uur na necrose) komen grote hoeveelheden GOT in het
serum vrij, met een maximum na 24 tot 48 uur. Indien
er geen leverlijden is duidt een nieuwe piek op
bijkomende necrose. Zware arythmieŽn en ernstige
angina pectoris kunnen evenwel ook GOT-stijging
veroorzaken. Ongecompliceerde hartdecompensatie of
longinfarcten veroorzaken weinig verandering van de
GOT-spiegels. GPT stijgt weinig of niet na infarct.
-
leverziekte: leverbeschadiging (infectieuze of
toxische hepatitis, congestie, galwegenobstructie,
actieve cirrose) veroorzaken een stijging van de GOT
en de GPT activiteit. Bij hepatitis treedt deze
stijging zeer vroeg op, gewoonlijk voor het
verschijnen van de icterus. De enzyme spiegels dalen
ook weer vlug en worden terug normaal nog voor totale
genezing van de parenchymletsels. De GPT daalt trager
dan de GOT. Obstructieve icterus, metastasen,
chronische actieve cirrose veroorzaken matige
stijging. Ook pancreatitis en mononucleosis infectiosa
geven een matige stijging van de transaminasen. Bij
cholecystitis zonder icterus blijven de transaminasen
in principe normaal.
-
sommige spierziekten (progressieve musculaire
dystrofie) (ook dermatomyositis) geven een matige
stijging van de GOT, weinig of geen stijging van de
GPT.
2
Lactaat dehydrogenase (LDH)
LDH komt voor in skeletspieren, lever, hart, nieren,
rode bloedcellen, hersenen, tumorcellen, atypische
lymfocieten. Het is dus een weinig specifiek enzyme.
Zijn stijging kan wijzen op een brede waaier van
aandoeningen: hemolyse, lever- of hartziekten, ook
andere aandoeningen. Zijn specificiteit wordt vergroot
door het scheiden van de isoŽnzymen:
LDH-isoenzymen
LDH heeft vijf
isoŽnzymen: genummerd van 1 tot 5 volgens de mobiliteit in een
elektrisch veld (elektroforese): de snelst bewegende
fractie is LDH1: LDH1 komt vooral voor in het hart en in
de rode bloedcellen (LDH1 = HBDH = Hydroxy boterzuur
dehydrogenase).
Het traagste isoŽnzyme is LDH5: LDH5 komt vooral voor in
de lever en de skeletspieren.
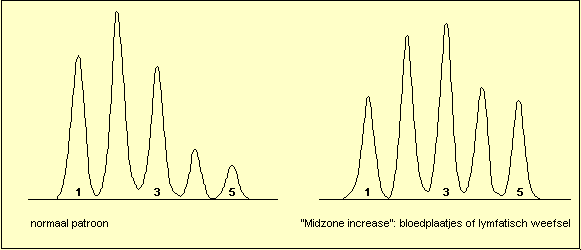
Wanneer de totale LDH-activiteit gestegen is kan men een
viertal patronen herkennen: stijging van LDH1, zodat
LDH1 hoger wordt dan LDH2 ("flipped") is het
hart en hemolyse patroon. Stijging van LDH5 duidt op
letsels van de lever of van de skeletspieren. Stijging
van LDH2, LDH3 en LDH4 ("Midzone increase")
wordt voornamelijk gezien bij aantasting van de
bloedplaatjes of van het lymfatisch systeem. Het niet
specifieke patroon (isomorf patroon) komt overeen met de
normale verdeling en laat geen specifieke diagnose toe.
Op volgende afbeeldingen worden enkele typische
patronen getoond. (voor het nut van LDH-isoŽnzymen bij
hartinfarct: zie ook "Laboratoriumdiagnose van Acuut Myocard Infarct")
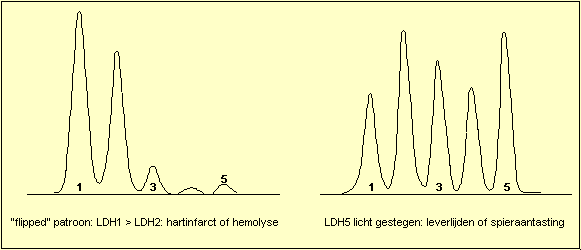
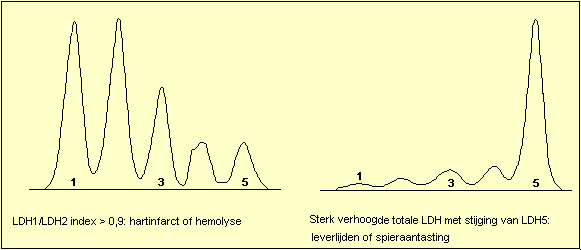
Klinisch nut:
-
Hartziekten
LDH en LDH-isoŽnzymen
worden meestal gevraagd om de diagnose van hartinfarct
te kunnen stellen of te bevestigen.
LDH stijgt relatief langzaam: de stijging begint 24
tot 72 uur na het infarct, en de hoge waarden blijven
10 tot 14 dagen bestaan.
De verhouding van de verschillende isoŽnzymen
verandert vůůr de stijging van de totale LDH-
activiteit begint: men kan na 24 uur reeds een
"flipped" patroon opmerken, bij normale
totale LDH. Dit omkeren van het LDH-isoŽnzyme patroon
is uiterst waardevol bij het stellen van de
differentiŽle diagnose tussen myocardinfarct en angina
pectoris.
Longziekten hebben geen invloed op de verhouding
LDH1/LDH2. Indien er bij hartziekte levercongestie
optreedt worden ook een aantal levercellen beschadigd
en zal ook LDH stijgen.
Ontstekingen van de hartspier verhogen ook LDH1:
myocarditis bijvoorbeeld produceert een
"flippend" isoŽnzyme patroon, maar de totale
LDH stijgt weinig. Ook hartoperaties veroorzaken een
tijdelijke (enkele dagen) omgekeerde LDH1/LDH2
verhouding.
-
Leverziekten:
LDH5 is het
lever-isoŽnzyme. Acute hepatitis veroorzaakt een
enorme LDH-stijging die volkomen voor rekening van
LDH5 komt. Deze stijging begint voor het verschijnen
van de icterus. LDH5 daalt vrij vlug, eerder dan
bijvoorbeeld GPT.
Ook toxische hepatitis (na geneesmiddelen) veroorzaakt
een stijging van LDH5. Bij mononucleosis infectiosa
stijgt de totale LDH soms zeer hoog, LDH5 stijgt
slechts matig. Cholangitis en obstructieve icterus
hebben slechts weinig invloed op LDH.
Bij levermetastasen is de verhouding LDH4/LDH5 meestal
groter dan 1,05. Een verhouding LDH4/LDH5 kleiner dan
1,05 wijst eerder naar primair hepatoma
(hepatocellulair carcinoma).
-
bloedziekten:
Het is zeer moeilijk een
onderscheid te maken tussen de verschillende
hematologische aandoeningen aan de hand van
LDH-isoŽnzymen: in het algemeen is LDH1 afkomstig van
de rode bloedcellen, LDH2 van de granulocieten, LDH3,
4, 5, van beschadigde lymfocieten. Lymfomen geven
evenwel een stijging van LDH2.
-
andere ziekten
Longweefsel
is rijk aan LDH3, en bij destructie van longweefsel
zal men dan ook een stijging van LDH3 zien.
Interpretatie is dikwijls echter moeilijk: bij
longinfarct bijvoorbeeld worden er ook een groot
aantal rode bloedcellen gehemolyseerd, met stijging
van, naast LDH3, ook LDH1: dan wordt de differentiŽle
diagnose met hartinfarct eerder moeilijk.
Skeletspieren bevatten vooral LDH5, met een
weinig LDH4 en LDH3. Na zware spierinspanning kan het
totale LDH stijgen, maar de verhouding LDH1/LDH2
blijft gelijk.
3.
Creatinine kinase
(CK of CPK : creatinine phospho-kinase)
Creatine fosfokinase komt voor in de gestreepte
spieren, de hartspier, de darm en de hersenen. Na
beschadiging van een gestreepte spiercel komt het CK
zeer snel vrij in het serum, na hersenbeschadiging
stijgt CK langzaam. Het enzyme wordt zeer vlug uit het
bloed verwijderd.
CK is waarschijnlijk een van de beste indicatoren van
hartinfarct: het stijgt zeer vlug en het komt zeer
weinig in andere weefsels voor.
Het feit dat minimale traumata van de skeletspieren ook
CK stijging kunnen veroorzaken maakt deze gevoelige
indicator echter weinig specifiek: spierarbeid, een val,
een intramusculaire injectie zijn voldoende om de
CK-spiegels omhoog te jagen.
CK heeft drie isoŽnzymen: MM, MB, BB. Ze kunnen met
verschillende technieken gescheiden worden. MM (M voor
muscle) komt voor in spier- en hartweefsel. BB (B voor
brain) komt voor in de hersenen. MB komt uitsluitend
voor in de hartspier.
In normaal serum vindt men MM en een spoortje MB. MB
komt in grote hoeveelheden in het serum na
myocardinfarct. BB wordt soms gevonden na acuut
hersenletsel, maagcarcinoma, prostaat carcinoma, en bij
patiŽnten die chronische dialyse of coronaire
bypasschirurgie ondergaan.
Wij gebruiken voor het bepalen van
CK-MB
een immunologische techniek waarbij alle M-componenten
geÔnactiveerd worden (MM en het M-deel van MB). Daarna
wordt de overblijvende activiteit gemeten, die dus
(meestal) een maat is voor de activiteit van CK-MB.
Klinisch nut:
-
Spierziekten
acute en voortschrijdende
spiernecrose veroorzaakt een astronomische stijging
van CK: deze stijging is een gevolg van de
beschadiging van actieve spiervezels, en is dan ook
het hoogst in het begin van de ziekte. Naarmate de
spiermassa vermindert, vermindert ook de hoeveelheid
circulerend CK en de enzyme activiteit heeft weinig
prognostische of diagnostische waarde bij gevorderde
spieraandoeningen.
CK-activiteit is hoger dan normaal bij de meeste
vrouwelijke carriers van musculaire dystrofie
(Duchenne - X-chromosoom gebonden), zonder evenwel
diagnostisch te zijn.
Ook polymyositis, dermatomyositis, zware
hypothyreoÔdie met spierafwijkingen geven verhoogde
CK-waarden.
-
hartziekten
de aanwezigheid van CK-MB is
de meest gevoelige "marker" van
myocardinfarct. CK-MB verschijnt vroeg (binnen de 24
uur na een infarct). Het stijgt niet na longembolen,
hartdecompensatie, angina pectoris (men heeft evenwel
ook stijging van CK-MB beschreven na spiertrauma,
langdurige tachy-arythmieŽn, zeer zware angina).
Het is waarschijnlijk niet mogelijk uit de stijging
van CK-MB conclusies te trekken betreffende de omvang
van het infarct: de stijging van de enzyme-activiteit
in het serum hangt niet alleen af van de
uitgebreidheid van de celnecrose maar ook van de
relatieve concentratie CK-MB in de aangetaste vezels
en van de bevloeiing van het geÔnfarcteerde deel.
Het is belangrijk bij de diagnose van een hartinfarct
een vrij strikte timing aan te houden: CK-MB is het
eerste enzyme dat in meetbare hoeveelheden in het
serum vrijkomt na een infarct: het kan soms aangetoond
worden binnen de 3 tot 6 uur na het begin van de pijn,
vůůr de stijging van het totale CK. Het maximum wordt
gewoonlijk bereikt na 12 tot 24 uur, en men vindt
opnieuw normale waarden na 24 tot 48 uur. Het is dan
ook belangrijk een serumstaal te nemen bij opname, en
controles te doen na 24 en 48 uur. Sommigen raden
zelfs een bloedname om de 12 uur aan om een (eventueel
kleine) stijging van CK-MB niet te missen.
4.
Gamma Glutamyl Transferase
(GGT of Gamma Glutamyl Transpeptidase,GGTP)
Gamma glutamyl transferase is een enzyme dat in hoge
concentratie voorkomt in de lever en in mindere mate in
de nieren. Het heeft een grote, zij het niet volledige,
lever- en galwegenspecificiteit, en de bepaling is in de
eerste plaats te beschouwen als een levertest.
Eigenaardig genoeg dalen de GGT-concentraties bij
zwangerschap of inname van orale contraceptiva, en een
patiŽnte met leverpathologie kan dus in deze
omstandigheden normale GGT-waarden hebben.
Klinisch nut:
-
Leverziekten
GGT is gestegen bij 75 tot
90 % van de patiŽnten met bewezen lever-of
galwegenpathologie. De hoogste waarden komen voor waar
cholestase aanwezig is: cholestatische hepatitis,
extrahepatische galwegenafsluiting, levermetastasen.
Bij acute hepatitis stijgt GGT trager dan de andere
enzymen, tenzij er een cholestatische component
aanwezig is. De activiteit blijft ook het langst
verhoogd. Bij actieve cirrose (vooral bij primaire
biliaire cirrose en alcoholische cirrose) en bij
chronische hepatitis worden zeer hoge waarden
gevonden.
GGT is zeer gevoelig aan alcoholgebruik, en kan dus
nuttig zijn bij de diagnose van chronische alcohol
abusus, of het houden van een onthoudingskuur (alcohol
stimuleert de produktie van GGT, en veroorzaakt
bovendien cholestatische leverletsels).
-
Andere aandoeningen
Acute pancreatitis
en acute opstoten van chronische pancreatitis doen GGT
stijgen.
Sommige nierziekten (zwaar nefrotisch syndroom,
rejecties bij niertransplanten, sommige maligne
niertumoren) veroorzaken verhoogde GGT waarden.
Hierbij enkele tabellen uit een artikel van J. Fevery
(cfr. referenties) over GGT.
-
|
"Klinisch nut" van serum GGTP
|
|
Als geÔsoleerde parameter
|
|
1 Indien normaal, kan een klinisch beduidend
leverlijden worden uitgesloten tenzij bij
zwangerschap en contraceptiva. Normaliseert
laattijdig na acute hepatitis (cfr.
thymol)
|
|
2 Hoogste waarden bij alcoholisch leverlijden,
cholestase (extrahepatisch
≥
intrahepatisch), levermetastasering.
|
|
3 In screening en follow-up van alcoholisme en
abstinentie (t/2 = 5 - 27 dagen).
|
|
In vergelijking met andere biochemische
parameters
|
|
1. GGTP
|
Alk. fosfatase
|
Bilirubine
|
|
|
zeer hoog
|
nl. of licht verhoogd
|
|
= alcohol
|
|
normaal
|
verhoogd
|
|
= skeletpathologie placentair,
zwangerschap
|
|
normaal
|
verhoogd
|
verhoogd
|
= kan toxische cholestase zijn door oestrogenen
of verwante steroÔden
|
|
verhoogd
|
normaal
|
laag normaal
|
= enzyme inductie
|
|
verhoogd
|
nl of licht verhoogd
|
normaal
|
= kan wijzen op levermeta's
|
|
minder hoog
|
hoog
|
zeer hoog
|
= bij sterke cholestase
|
|
2. GGTP
|
SGPT
|
kan wijzen op:
|
|
minder of gelijk gestegen dan
|
SGPT
|
acute hepatitis
|
|
iets meer gestegen dan
|
SGPT
|
chronische hepatitis
|
|
laag tot normaal
|
nog hoge SGPT
|
slechte evolutie (fulminante hepatitis)
|
|
3. Bij cirrose
|
|
|
GGTP/SGPT 30 ( 14)
|
verwijst naar alcohol (of p. biliaire) als
etiologie
|
|
GGTP/SGPT 4,5
|
post hepatitis
|
5. Fosfatasen
Alkalische fosfatasen
Alkalische fosfatasen komen voor in lever, beenderen,
darm, placenta. De normale serumactiviteit van ALP is
afkomstig van de lever en de beenderen. Bij kinderen en
adolescenten predomineert vooral de beender-ALP.
Intestinaal ALP komt soms in het serum na een maaltijd
en placentair ALP tijdens het derde trimester van de
zwangerschap. Verhoogde ALP-waarden bij nuchtere, niet
zwangere volwassenen zijn meestal terug te voeren tot
lever- of beenderletsels.
Klinisch nut:
-
beenderziekten: allerhande beenderziekten
zoals ziekte van Paget, hyperparathyroidie,
beenmetastasen, osteomalacie, osteo-sarcomen,
hyperphosphatemie, veroorzaken stijging van ALP.
-
leverziekten: vooral leverziekten gekenmerkt
door cholestase veroorzaken stijging van ALP (cfr.
GGT): obstructie van de ductus communis (stenen,
striktuur, tumoren); biliaire cirrose;
"drug-induced" cholestatisch icterus; virale
hepatitis met cholestase; infiltratie van de lever bij
metastasen, sarcoidosis, lymfomen, etc. Bij chronische
actieve hepatitis of levercongestie ziet men slechts
zelden een stijging van ALP.
-
andere ziekten: Pancreatitis en niertumoren
kunnen soms verhoogde ALP-waarden veroorzaken.
Bepaling van
iso-enzymen van alkalische fosfatasen
is mogelijk, maar heeft eerder beperkte indicaties.
Zure fosfatasen (ACP of Acid phosphatase)
Komt voornamelijk voor in de prostaat, in zeer geringe
mate in rode bloedcellen, bloedplaatjes, etc.
Duidelijk verhoogde waarden duiden praktisch altijd op
prostaatcarcinoom. Prostaathypertrofie en prostatitis
veroorzaken geen verandering van de enzym-spiegels.
Na prostaatmassage, of zelfs na onderzoek van de
prostaat, kan de ACP-waarde binnen enkele uren stijgen.
Men raadt dan ook aan bloed voor ACP af te nemen vůůr
onderzoek van de prostaat, of minstens 24 uur na het
onderzoek. Prostaatinfarct, transurethrale resectie van
de prostaat veroorzaken ook ACP-stijging.
Bij 19 % van patiŽnten met beendermetastasen, 2 % met
levermetastasen, 6 % met tumoren zonder lever- of
beenderinvasie, 10 % met primaire beenderkankers is de
ACP-activiteit verhoogd. Ook bij ziekte van Paget (21
%), bij hyperparathyroidie (3/9) en sommige andere
beenderziekten ziet men de ACP-waarde stijgen.
De bepaling van
totale zure fosfatasen
wordt niet meer uitgevoerd.
Dit onderzoek is vervangen door de bepaling van
tartraat-zure fosfaten en van
PSA
(Prostaat Specifiek Antigeen)
Meer uitleg over der verschillende testen en een
verduidelijking van de nomenclatuur vindt men in
"Laboratoriumonderzoeken bij prostaatkanker).
6.
Amylase
Amylase is een enzyme dat afgescheiden wordt door
sommige exocriene klieren: pancreas en speekselklieren.
Veel lagere activiteit komt voor in de ovaria, de dikke
en de dunne darm, spierweefsel.
Bij celbeschadiging komt niet-gesecreteerd enzyme in de
bloedbaan en bij opstoppen van de afvoerwegen zal enzyme
doorsijpelen naar het serum. De hoeveelheid enzyme die
bij celbeschadiging vrijkomt hangt af van het trauma, en
van de functionele toestand van de cellen.
Amylase wordt snel uit het serum verwijderd door de
nieren.
Klinisch nut:
-
Pancreasziekten:
stijging van
serumamylasen wijst meestal op pancreaslijden. Bij
acute pancreatitis stijgen de waarden binnen enkele
uren.
Amylase is een zeer kleine molecule, en het wordt zeer
vlug door de nieren uit het bloed geklaard. De
verhoogde waarden dalen dan ook zeer vlug: binnen 48
tot 72 uur kan de serumspiegel terug normaal zijn,
terwijl de acute ontsteking doorgaat. In dit geval kan
het aantonen van grote hoeveelheden amylase in de
urine belangrijk zijn.
Dalen van de amylase-spiegels kan dus wijzen op:
-
vermindering van de ontsteking.
-
uitscheiding van het enzyme door de nieren
(verhoogde amylasurie).
-
functionele ineenstorting van de pancreas (er
zijn geen kliercellen meer over om het enzyme aan
te maken!).
Ook zonder pancreatitis kan spasme van de sfinkter van
Oddi (morfine!, radioŲpake substanties!) sterke stijging
van de amylase-concentraties veroorzaken.
-
Andere ziekten: bij
chemische irritatie van de pancreas kunnen de
waarden van amylase stijgen: geperforeerde maagzweer,
galblaas empyeem, darmobstructie, geruptureerde
extra-uteriene zwangerschap, peritonitis.
De stijging van de amylasemie is hier waarschijnlijk
te wijten aan pancreasirritatie of voorbijgaande
pancreasontsteking, met resorptie van de enzymen door
de gedilateerde bloedvaatjes.
-
Chronische pancreatitis veroorzaakt weinig
stijging, carcinoma van de pancreas veroorzaakt in
principe gťťn stijging van het enzyme.
-
Bij nierinsufficiŽntie wordt het enzyme niet
uitgescheiden en vindt men verhoogde waarden, zonder
pancreaslijden. De serumwaarden kunnnen stijgen tot 3
x de normale waarden. Hogere stijging moet doen denken
aan pancreatitis. Bij kunstnierpatiŽnten is een
stijging van de waarden dan ook belangrijker dan ťťn
enkele verhoogde waarde.
-
Bij parotitis vinden we verhoogde amylase-waarden.
Er bestaat een abnormale vorm van het enzyme
(macro-amylasemie), waarbij amylasen gebonden zijn aan
een serumeiwit. Dit complex kan niet uitgescheiden
worden door de nieren. De bloedspiegels van amylasen
zijn dan ook verhoogd, de amylasurie is laag of normaal.
Het scheiden van amylase in verschillende isoŽnzymen is
mogelijk, maar wordt zelden of nooit uitgevoerd: de
differentiŽle diagnose tussen pancreas- en
speekselklierlijden is gewoonlijk niet moeilijk, en bij
twijfel kan het bepalen van de lipase activiteit hulp
bieden.
7.
Lipase
Lipase is een ander enzyme dat door de pancreas
afgescheiden wordt in het duodenum. Het komt in het
bloed na letsels van de pancreas (het enige orgaan dat
lipase bevat). Lipasen worden niet uitgescheiden door de
nieren, en de waarden blijven dan ook langer verhoogd.
Acute pancreatitis is de voornaamste oorzaak van
verhoogde lipasemie. De waarden lopen parallel met de
amylase activiteit in het begin van de ziekte, maar ze
blijven langer verhoogd. Lipase kan dus helpen bij
laattijdige diagnose van pancreatitis. Het is van weinig
nut bij chronische pancreatitis, bij chronische galwegen
aandoeningen, bij carcinoma van de pancreas. Ziekten van
de speekselklieren hebben geen invloed op de waarden van
de lipase.
Bij chronische nierinsufficiŽntie is de
lipase-activiteit in het serum verhoogd. Deze waarde
stijgt tijdens dialyse, waarschijnlijk door vetafbraak,
geinduceerd door heparine. Ook hier (zoals bij amylase)
is een stijging van de gevonden waarden een belangrijke
aanduiding voor pancreatitis, meer dan ťťn enkele
verhoogde waarde.
8.
Cholinesterase(CHE)
Twee soorten cholinesterase zijn gekend:
"echte" cholinesterase of
acetyl-cholinesterase
en"pseudo"cholinesterase.
Acetylcholinesterase komt voor in alle weefsels, maar
vooral in de grijze hersenstof. Pseudocholinesterase
wordt gevormd in de lever en komt in alle weefsels voor.
Zijn juiste betekenis is niet gekend. Wij bepalen in ons
laboratorium pseudocholinesterase.
De bepaling van cholinesterase in serum is aangewezen
als test van de leverfunctie, als indicator van
vergiftiging door insekticiden en voor het
opsporen van patiŽnten met atypische vormen van
dit enzyme. Normale waarden gaan in ons laboratorium van
4,65 tot 10,65 U/ml, en deze waarden zijn bij ťťn
persoon vrij constant. Bij de geboorte zijn de waarden
laag, maar ze lopen snel op en bereiken de volwassen
waarde rond de tweede levensmaand.
Bepalen van cholinesterase is een
gevoelige leverfunctietest. Een daling van 10%
bij een bepaalde persoon wijst (in afwezigheid van
inhibitoren) op verminderde synthese in de lever. Bij
acute of langdurige chronische hepatitis ziet men 30 tot
50 % daling van de activiteit. Gevorderde cirrose of
levermetastasen veroorzaken een daling van 50 tot 70 %
van de normale activiteit. Bij milde vormen van
chronische hepatitis, bij lichte cirrose (zonder zware
aantasting van de leverfunctie) vindt men praktisch
normale waarden. Ook bij obstructieve icterus blijven de
waarden normaal.
Vele organische insekticiden (Parathionį enz.)
inhiberen de cholinesterase activiteit. Vooral land- en
tuinbouwers zijn blootgesteld aan contact met deze
giften. Een asymptomatische vergiftiging (door contact
met de huid, de slijmvliezen of door inhalatie) kan
reeds een verlaging van 40 % van de enzymeactiviteit
meebrengen. Bij een daling van 80 % ziet men ernstige
neuromusculaire tekens. Bij zware vergiftigingen vindt
men geen enzymeactiviteit.
Succinylcholine (Suxamethoniumį, Myoplegineį)
lijkt erg op acetylcholine, en het wordt ook
gehydroliseerd door cholinesterase. PatiŽnten met een
lage enzymeactiviteit, of patiŽnten met atypische vormen
van het enzyme, breken dit medicament niet snel genoeg
af, en dit kan aanleiding geven tot verlengde apnee. Men
raadt daarom aan de cholinesterase activiteit te bepalen
bij patiŽnten die succinylcholine zullen toegediend
krijgen. Verlaagde waarden (verworven of aangeboren)
vormen een tegenindicatie voor de toediening van
succinylcholine. Atypische varianten van cholinesterase
(aangeboren) kunnen hiermee niŤt uitgesloten worden:
hiervoor is de bepaling van de enzymeactiviteit na
inhibitie met dibucaine of fluoride nodig. Deze bepaling
kan voorlopig nog niet uitgevoerd worden in ons
laboratorium.
Verlaagde waarde van cholinesterase kan ook gevonden
worden bij acute infecties, longembolen, spierdystrofie,
myocard infarct, chronische nierinsufficiŽntie en
zwangerschap. Ook na heelkundige ingrepen kan er een
tijdelijke onderdrukking van de cholinesterase
activiteit zijn.
9. Aldolase (ALD)
Komt in alle cellen in mindere mate voor, maar toch
hoofdzakelijk in skelet en hartspier. Ook de lever bevat
matige hoeveelheden aldolase.
Stijging komt voor bij spieraandoeningen, leverziekten,
hartinfarct. Het biedt evenwel weinig bijkomende
informatie in de meeste gevallen.
Dit onderzoek wordt NIET meer uitgevoerd.
10.
Leucine Amino Peptidase (LAP)
LAP komt voor in pancreas, lever en duodenum. Zijn
bepaling kan soms nuttig zijn: het is zeer specifiek
voor hepato-biliaire aandoeningen.
|
|














