|
Ned Tijdschr Klin Chem 2000; 25:
31-37
Kritische evaluatie van
de chemische diagnostiek van erfelijke stofwisselingsziekten
W. RUITENBEEK, J. de
JONG, W. M.J. HEIJS en J.M.F. TRIJBELS
Erfelijke
stofwisselingsziekten vertonen een zeer heterogeen beeld zowel qua
klinische als
(bio-)chemische aspecten. De arts zal een voorselectie van verdachte
patiŽnten maken, waarna het metabole laboratorium de chemische diagnostiek
zo adequaat mogelijk dient uit te voeren.
Een belangrijke factor daarbij
is dat de juiste lichaamsvloeistoffen worden aangeboden, in combinatie met
alle beschikbare relevante klinische informatie. De keuze van de uit te
voeren onderzoeken hangt af van de medische vraagstelling.
Ook oriŽnterend klinisch-chemisch onderzoek speelt in een vroege fase in de diagnostische
procedure een voorname rol. De meest bekende metabole stoornissen worden
genoemd met vermelding van richtinggevend vooronderzoek en juiste
onderzoeksmateriaal.
In het merendeel
van de gevallen zal urine en serum noodzakelijk zijn voor een verantwoorde screening. Naast het geven van aanwijzingen over deze aspecten wordt ook
het belang benadrukt van uitwisseling van informatie tussen de diverse
aanvragende en uitvoerende specialisten.
Deze verschillende aspecten zijn
belangrijk bij het verhogen van de kwaliteit en de efficiŽntie van het
chemisch onderzoek voor het opsporen en vervolgen van patiŽnten met een
erfelijke stofwisselingsziekte.
Het opsporen van
erfelijke stofwisselingsziekten vindt plaats in diverse stadia. En er zijn
verscheidene disciplines bij betrokken.
De eerste fase is nagenoeg altijd
klinisch georiŽnteerd. Op basis van de symptomen en familieanamnese zal de
betrokken kinderarts, internist, neuroloog of huisarts op de gedachte
gebracht kunnen worden, dat er bij de patiŽnt een metabole route
onvoldoende functioneert.
Op een centraal klinisch- chemisch laboratorium
zullen dan de eerste routinematige bepalingen gedaan worden. Veelal zal
die fase gevolgd worden door metabolietenonderzoek (aminozuren, organische
zuren, enz.) op een laboratorium dat gespecialiseerd is in het vaststellen
van erfelijke stoornissen in de stofwisseling.
Soms is de diagnose na het
metabolietenonderzoek al nagenoeg definitief te stellen, bijvoorbeeld bij fenylketonurie en methylmalonacidurie. In andere gevallen is metabolieten-
onderzoek richtinggevend voor vervolgonderzoek op enzym- en/of DNA-niveau.
Of deze logische volgorde in de praktijk moet worden gevolgd, hangt af van
onder andere de specificiteit van de symptomen en van de complexiteit van
de in aanmerking komende laboratoriumtechnieken. Een meer directe weg kan
uiteraard bewandeld worden als het type stofwisselingsziekte al bekend is
binnen de familie van de verdachte patiŽnt.
Medische Indicatie:
De
eerste aanwijzingen voor een eventuele stofwisselingsstoornis zullen
verkregen worden via de symptomen en klachten bij de indexpatiŽnt,
mogelijk ook via familieanamnese. Bij welke symptomen de
( behandelend )
arts aan een metabool defect moet denken komt hier niet uitvoerig aan de
orde.
Bij een uitgebreid scala aan symptomen en klachten kan een metabole
stoornis de oorzaak zijn.
Frequent bij stofwisselingsziekten voorkomende
klachten zijn: mentale en motorische retardatie, convulsies, lethargie,
braken, hypoglycemie, absences, (sub-)coma, sudden infant death, failure
to thrive, groeiretardatie, dysmorfieŽn, hypo/hypertonie, cardiomyopathie,
nierstenen, knik in de ontwikkeling, myalgie, spraakstoornis, diarrhee,
afwijkend EEG-patroon en vele andere.
Een groot probleem is dat patiŽnten
dikwijls een combinatie van symptomen vertonen, die niet in alle details
voldoet aan het in de literatuur beschreven beeld.
Het is niet
verwonderlijk dat de fenotypen van stofwisselingsziekten zo verschillend
zijn. Immers de aard en locatie van metabole defecten zijn zeer divers.
Het betreft enzymatische en transportdefecten in bepaalde celorganellen
(lysosomen, mitochondriŽn, peroxisomen), die systemisch van aard kunnen
zijn.
Maar ook weefselspecifieke defecten, waarbij ťťn of enkele organen (o.a.
hersenen, lever, nier, spier) zijn aangedaan, zijn bekend.
Momenteel zijn
meer dan vijfhonderd verschillende erfelijke stoornissen in de
stofwisseling bekend. Het is uiteraard geen eenvoudige zaak om bij de
juiste patiŽnt het juiste metabool defect te overwegen.
De mate van
ervarenheid van de arts speelt een grote rol bij het combineren van de
klinische signalen tot een werkzame en juiste differentiaal diagnose. In
de literatuur is veel informatie te vinden over de medische
indicatiestelling bij zowel metabole ziekten in het algemeen (1-3) als
over meer specifieke ziektebeelden (4-11).
Het nut van klinische
informatie als onderdeel van het totale proces om tot een metabole
diagnose te komen werd ook onderstreept op het jubileumcongres van de
Stichting Kwaliteitsbewaking Ziekenhuis Laboratoria (SKZL) (12).
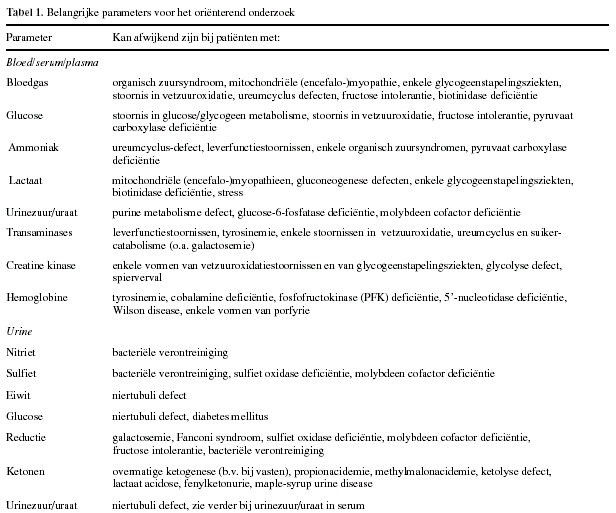
OriŽnterend klinisch-chemisch onderzoek vooraf :
De resultaten van verscheidene klinisch-chemische
analyses, in een vroeg stadium op een min of meer routinematige wijze
uitgevoerd, kunnen richtinggevend zijn voor het diagnostisch
vervolgtraject.
Een van de eerste oriŽnterende onderzoeken zal zijn
de bloedgasanalyse, zeker wanneer er sprake is van metabole ontregeling
bij de patiŽnt. Deze analyse is niet alleen van wezenlijk belang voor het
bewaken van de vitale functies van de patiŽnt.
Een verlaagde bloed pH
bijvoorbeeld kan een eerste aanwijzing zijn voor een forse productie van
organische zuurmoleculen. Diverse defecten in het catabolisme van
aminozuren gaan gepaard met acidose. Defecten in de vetzuurverbranding
laten soms acidose zien. Een verlaagde capaciteit tot oxideren van
pyruvaat kan leiden tot lactaat acidose.
Glucosespiegel
Vanzelfsprekend is kennis over de glucosespiegel in
bloed zeer belangrijk. Een verlaagde glucosespiegel kan duiden op een
endocrinologisch probleem, bijvoorbeeld hyperinsulinisme, maar ook op een
gestoorde gluconeogenese of een defect in de glycogenolyse.
Soms zijn de
consequenties van een stoornis in een ander deel van de energiehuishouding
zo ernstig, dat daardoor hypoglycemische periodes ontstaan. Dit kan met
name bij stoornissen in de mitochondriŽle vetzuuroxidatie optreden. Het
achterwege blijven van een adequate ketozuurproductie tijdens een
hypoglycemische periode kan duiden op een probleem in het
vetzuurverbruik.
Ammoniakspiegel
Diverse stoornissen zijn geassocieerd met een
verhoogde ammoniakspiegel in bloed. Verhoogd ammoniak wordt natuurlijk
gezien bij slecht functioneren van de ureumcyclus. Dit kan ten gevolge van
een primair enzymdefect in deze cyclus voorkomen. Maar de
ammoniakverhoging kan ook het gevolg zijn van verlies van metabole
functies van de lever. Secundair aan het primaire enzymdefect wordt
hyperammonemie ook bij bepaalde organisch zuursyndromen aangetroffen,
zoals bij propion- en methylmalonacidurie.
Lactaatspiegel
Een verhoogde lactaatspiegel in bloed kan een
indicatie zijn voor een stoornis in de pyruvaatomzetting (mitochondriŽle
encephalomyopathieŽn, pyruvaat carboxylase deficiŽntie), maar wordt ook
gezien bij enkele typen stoornissen in het glycogeen/glucose metabolisme
(glycogeen synthetase deficiŽntie, debrancher enzym deficiŽntie,
glucose-6-fosfatase deficiŽntie, glucose-6-fosfaat transporter
deficiŽntie, fosforylase kinase deficiŽntie, fructose-1,6-difosfatase
deficiŽntie) en bij enkele vormen van organische zuursyndromen. Verder kan
stress en ischemie gemakkelijk hoge bloed lactaatconcentraties
veroorzaken.
Urinezuurspiegel
Een verhoogd of verlaagd
urinezuurgehalte in bloed kan duiden op een enzymatisch defect in het
purine-metabolisme; afhankelijk van de locatie van het enzymdefect is de
concentratie van het urinezuur verhoogd dan wel verlaagd.
Serumenzymen
Verhoogde transaminase activiteiten in bloed worden
gezien bij patiŽnten met een aangetaste lever, maar eveneens bij patiŽnten
met bepaalde typen deficiŽntie in de vetzuuroxidatie (medium-chain
acyl-CoA dehydrogenase deficiŽntie, carnitine palmitoyltrans-ferase
deficiŽntie, glutaaracidurie type II), in de ureumcyclus en in het
suikercatabolisme (debrancher enzym deficiŽntie, brancher enzym
deficiŽntie, spier-en lever-type fosforylase deficiŽntie, fosforylase
kinase deficiŽntie, galactosemie, hereditaire fructose intolerantie).
Een
specifieke toename van creatine kinase activiteit in serum treedt op bij
enkele vormen van gestoorde vetzuuroxidatie (zeer-lang-keten acyl-CoA
dehydrogenase deficiŽntie, lang-keten-3-hydroxy-acyl-CoA dehydrogenase
deficiŽntie, carnitine palmi-toyltransferase II deficiŽntie,
glutaaracidurie type II). Ook bij enkele typen glycogeenstapelingsziekten
is de serum creatine kinase verhoogd. Een geÔsoleerde verhoging van
lactaat dehydrogenase kan duiden op lysinurische eiwitintolerantie (LPI of
dibasische aminoacidurie)
Hemoglobinegehalte
Een verlaagd hemoglobinegehalte kan eveneens van
diagnostisch belang zijn, daar anemie bij enkele, meest vrij zeldzame,
typen stofwisselingsziekten voorkomt. Voor meer gedetailleerde informatie
over oriŽnterend bloedonderzoek bij verdenking op een metabole stoornis
wordt verwezen naar ref. 13.
Urineanalyse
Ook in urine kunnen enkele eenvoudige oriŽnterende
onderzoeken van nut zijn. Een min of meer specifieke geur kan reeds een
goede aanduiding zijn voor een specifieke metabole stoornis, b.v.
isovaleriaanacidurie (zweetvoetengeur), maple-syrup urine disease
(verbrande suikergeur), trimethylaminurie (visgeur).
Met een
multifunctionele dipstick kunnen verscheidende parameters simpel en snel
semi-kwantitatief worden gemeten. Zo kunnen het eiwit- en glucosegehalte
informatie opleveren over het functioneren van de niertubuli. Nitriet
en/of sulfiet verhogingen wijzen veelal op bacteriŽle contaminatie. Maar
een verhoogde sulfietexcretie kan ook veroorzaakt zijn door een primaire
of secundaire deficiŽntie van sulfiet oxidase.
Een duidelijk positieve ketonentest maakt een stoornis in de vetzuuroxidatie of ketogenese minder
waarschijnlijk. Een positieve ketonentest kan overigens een indicatie
vormen voor een defect in de ketolyse, voor propionacidemie of voor
methylmalonacidurie. Bij de interpretatie van de ketonentest moet men zich
bewust zijn van het feit, dat veel soorten ketonen-testen niet specifiek
zijn voor acetoacetaat, maar reageren met diverse componenten met een
ketogroep, zoals pyruvaat, aceton, 2-oxo-organische zuren, enz.
Met een
test op reducerend vermogen kunnen verhoogde concentraties van reducerende
verbindingen als glucose, fructose en galactose aangetoond worden. Bij een
positieve reductie bij neonaten moet men zeker bedacht zijn op
galactosemie.
Wel moet men zich bewust zijn van het feit, dat vermelde
testen een beperkte specificiteit kunnen hebben en er met name gemakkelijk valspositieve resultaten gevonden kunnen worden. Voor een eerste
oriŽntatie zijn ze echter heel bruikbaar.
Een verhoogd of verlaagd
urinezuurgehalte kan in urine, evenals in serum, duiden op een gestoorde
purine stofwisseling, en op glycogeen stapelingsziekte type I. In tabel 1
zijn de belangrijkste parameters samengevat, die in aanmerking komen voor
vooronderzoek. Daarbij zijn de meest bekende stofwisselingsziekten
opgenomen, waarbij de parameter in het algemeen een verhoogde of verlaagde
waarde laat zien. Daarnaast zijn enkele condities vermeld, die de
interpretatie van de testresultaten kunnen bemoeilijken.
Type lichaamsvloeistof:
Het komt veelvuldig
voor dat van een patiŽnt Úf serum Úf urine wordt ingestuurd. Welk van
beide lichaamsvloeistoffen wordt ingestuurd lijkt soms meer bepaald door
praktische omstandigheden dan door overwegingen van diagnostische aard.
Bij een sterke verdenking op een specifieke afwijking kan ťťn type
lichaamsvloeistof toereikend zijn. Bijvoorbeeld urine bij nierstenen. Bij
minder specifieke verdenking, zoals in het gros van de aanvragen het geval
is, zal naast urine ook serum of plasma noodzakelijk zijn voor een
verantwoord diagnostisch onderzoek. In tabel 2 zijn een aantal belangrijke
metabole stoornissen opgesomd met vermelding van de lichaamsvloeistof(fen),
waarin de meest kenmerkende metabolieten aangetroffen kunnen worden.
Urine
Een voordeel van onderzoek van urine boven dat van
serum is dat een beter tijdsgemiddelde verkregen wordt, zelfs indien een
portie en geen 24-uurs urine gebruikt wordt. Voor een eerste diagnostisch
onderzoek is overigens zelden een 24-uurs urine vereist. Veel schadelijke
componenten worden door de nier-tubuli uit de bloedbaan verwijderd,
waardoor hun concentratie in urine veel hoger is dan in bloed.
Ziektebeelden, die leiden tot accumulatie van organische zuren, kunnen
daardoor gemakkelijker in urine dan in serum worden opgespoord. Tot deze
groep behoren de belangrijkste klassieke organoacidurieŽn. Een deficiŽnte
stap in de afbraakroute van een aminozuur vormt dikwijls de primaire
oorzaak in deze groep van ernstige ziektebeelden. Een tweede groep,
waarbij urine de belangrijkste analysevloeistof is, is die waarbij
nierafwijkingen een rol spelen. Een te geringe terugresorptie door
niertubuli leidt tot een te hoge excretie van een aminozuur of groep
aminozuren. Bekende voorbeelden zijn de gegeneraliseerde aminoacidurie (Fanconi
syndroom) en cystinurie.
Bij nierstenen moet zowel het spectrum van de
aminozuren, organische zuren als purines/ pyrimidines bepaald worden,
omdat (de homozygote vorm van) cystinurie, hyperoxalurie en xanthinurie de
oorzaak van de steenvorming kunnen zijn. Een bijzonderheid is de
lysinurische eiwit intolerantie (LPI). Het betreft hier een
transportdefect voor de dibasische aminozuren arginine, lysine en
ornithine, niet alleen in nier- maar ook in darmcellen. De uitscheiding
van deze aminozuren is in de urine van LPI-patiŽnten extreem verhoogd,
terwijl de bloedspiegels veel minder afwijkend of zelfs normaal zijn.
Diagnosestelling via urineonderzoek is dan ook noodzakelijk. Stoornissen
in de afbraak van purines en pyrimidines zullen in het algemeen via
urineonderzoek opgespoord worden. Voor vervolgonderzoek is soms plasma
gewenst. Plasma is ook gewenst bij immuun-deficiŽnties, waarbij adenosine
deaminase of purine nucleoside fosforylase defect kan zijn. Voor het
aantonen van een 5í-nucleotidase deficiŽntie zijn leukocyten vereist. In
leukocyten kan desgewenst ook het nucleotidenpatroon bepaald worden.
Een andere categorie stofwisselingsziekten, die via
analyse van urine is op te sporen betreft een aantal van de lysosomale
stapelingsziekten. Een afwijkend excretiepatroon van mucopolysacchariden,
oligosac-chariden of neuraminezuur duidt op respectievelijk een
mucopolysaccharidose, oligosaccharidose of een
neuraminezuur-transportprobleem. De mogelijkheden en beperkingen van dit
type urineonderzoek komen elders in dit nummer uitvoerig aan de orde (14).
Met name de lipidosen en sommige typen sfingolipidosen zijn niet via
metabolietenanalyse uit te sluiten.
Analyse van uitgescheiden suikers (oligo- of
monosacchariden) kan ook andere ziektebeelden aan het licht brengen. Zo
duidt het zogenaamde tetraglucoside-bandje bijvoorbeeld op intracellulaire
stapeling van glycogeen. Analyse van monosacchariden en polyolen met
behulp van gaschromatografie kan via een verhoogde uitscheiding van
galactose en galactitol de diagnose galactosemie opleveren. Bepaling van
gal-alcoholen in urine kan leiden tot de diagnose cerebro-tendineuze
xanthomatose (CTX).

Serum/plasma
Onderzoek in serum of plasma is voor een aantal
metabole stoornissen te prefereren boven onderzoek in urine. In een aantal
gevallen is serum zelfs vereist voor het stellen van de diagnose.
Een
eerste indicatie voor een peroxisomale ziekte kan verkregen worden door
bepaling van concentraties en ratioís van zeer-langketen vetzuren en van
de concentratie van fytaan-zuur in serum. Analyse van vetzuren in serum
kan een aanwijzing opleveren voor een defect in de oxidatie van lang-keten
vetzuren.
Zo is een verhoogde spiegel van tetradeceenzuur in serum
indicatief voor een stoornis in de mitochondriŽle oxidatie van
lang-ketenvetzuren. Verder kan een verlaging in serum van het
carnitinegehalte of een toename van veresterd carnitine duiden op een
gestoorde vetzuurverwerking of een organisch zuursyndroom.
Meer specifieke
informatie over het type vetzuuroxidatiedefect kan verkregen worden via
typering van de carnitine-esters in serum, de zogenaamde
carnitine-esterprofilering. Urineonderzoek kan indicaties opleveren voor
defecten in de vetzuuroxidatie middels verhoogde excretie van
vetzuurderivaten.
Zo worden bij medium-chain-acyl- CoA dehydrogenase
deficiŽnte patiŽnten glycine- conjugaten en vaak dicarbonzuren gevonden.
Men moet er op bedacht zijn, dat bij meerdere patiŽnten met een lang-keten
vetzuuroxidatiestoornis echter vaak alleen in zogenaamde crisisurine een
verhoogde uitscheiding van vetzuurderivaten voorkomt. De klinische en/of
metabole situatie van de patiŽnt is dan zodanig, dat het lichaam een fors
beroep doet op het verbruik van vetzuren. Onderzoek van uitsluitend een
willekeurige portie urine kan bij deze categorie dus vals-negatieve
resultaten opleveren.
Voor het vaststellen van de glycosyleringsgraad van
transferrine, die afwijkend is bij het zgn. carbohydrate-
deficient-glycoprotein (CDG) syndroom, is ook serum vereist (15).
Serumonderzoek is eveneens noodzakelijk voor het stellen van de diagnose Smith-Lemli- Opitz (SLO) syndroom, en andere ziekten waarbij het laatste
gedeelte van de biosynthese van cholesterol in het geding is. Bij
verdenking op dit soort afwijkingen wordt de eventuele accumulatie van
precursors van cholesterol onderzocht. Veel stoornissen in het catabolisme
van aminozuren kunnen beter in serum dan in urine vastgesteld worden. Het
organisch zuurpatroon in urine kan hierbij ondersteunend werken.
Zo worden
de diagnoses fe-nylketonurie (PKU), tyrosinemie, maple-syrup urine disease,
hyperprolinemie, niet-ketotische hyperglycinemie en hyperhomocysteÔnemie
in eerste instantie via serumanalyse gesteld. Defecten in de biosynthese
van serine kunnen slechts in nuchter serum of in liquor opgespoord worden.
Veelal beÔnvloeden medicijnen het aminozuurspectrum in serum minder dan
dat in urine. Zo stoort paracetamol alleen in urine. Antibiotica storen
minder in serum dan in urine. Serum heeft ook het voordeel dat het
beduidend minder onbekende componenten bevat dan urine, hetgeen de
interpretatie van de analyse vereenvoudigt.
Liquor
Onderzoek in liquor is vereist in een klein aantal
gevallen van erfelijke stofwisselingsziekten. De diagnose niet-ketotische
hyperglycinemie kan slechts gesteld worden aan de hand van de ratio van de
glycineconcentratie in liquor en serum.
Het vaststellen van afwijkingen in
het gamma-aminoboterzuur (GABA) metabolisme vereist eveneens analyse van
liquor.
Dit geldt ook voor defecten op het gebied van neurotransmitters en
biogene amines (16,17).
Liquor is zeker ook nuttig bij het opsporen van
een gestoorde serine-bio-synthese. Verder vertonen sommige patiŽnten met
een mitochondrieel enzymdefect lactaataccumulatie alleen in liquor,
bijvoorbeeld veel patiŽnten met het Leigh-syndroom. In uitzonderlijke
gevallen, wanneer secundaire factoren met betrekking tot aminozuren in
serum het primaire defect kunnen maskeren, bijvoorbeeld bij ernstig
leverlijden of parenterale voeding, kan liquor-onderzoek uitkomst bieden.
Een nuttig overzicht van de mogelijkheden van liquorstudies met
interessante voorbeelden is van de hand van Hoffmann, Surtees en Wevers
(18). Men mag aannemen dat uitbreiding van liquor-analyse in de toekomst
nog diverse nu onbekende defecten in enzymen of transportsystemen aan het
licht zal brengen.
Uitwisseling van informatie
Voor een efficiŽnte metabole screening is het van
groot belang dat de juiste klinische en klinisch-che-mische gegevens
worden doorgegeven aan het meta-bool georiŽnteerde laboratorium, dat het
vervolgonderzoek zal gaan uitvoeren.
De meeste van deze laboratoria in
Nederland hebben hiertoe formulieren ontworpen, die toegespitst zijn op de
betreffende vraagstelling en de specifieke mogelijkheden van het
laboratorium. Een zo compleet en correct mogelijke invulling kan in de
praktijk veel tijdsverspilling voorkomen, zowel bij de administratieve
afhandeling als de uitvoering en interpretatie van de analyses. Op basis
van deze informatie wordt namelijk door een ervaren metabool geschoolde
chemicus, vaak in samenspraak met een ter zake deskundige kinderarts, een
diagnostisch programma opgesteld.
Het vermelden van alleen de verdenking
op een min of meer specifiek ziektebeeld geeft in het algemeen veel minder
informatie dan vermelding van de symptomen en klachten. Uit de opgegeven
medische indicaties is niet altijd de ernst van de klinische situatie in
te schatten.
Melding van de patiŽnt door de aanvragende specialist bij de
kinderarts Metabole Ziekten van het onderzoekcentrum is gewenst in die
gevallen, waarbij een snellere screening dan gebruikelijk van belang is,
bijvoorbeeld in acute levensbedreigende situaties voor het instellen van
een dieet of medicatie, of het uitvoeren van een ingrijpende handeling. In
dergelijke gevallen dient de komst van onderzoeksmateriaal bij het
metabole laboratorium tijdig aangekondigd te worden.
Naast de medische indicatie is het van groot belang
de medicatie nauwkeurig op te geven. Diverse soorten medicamenten kunnen
een aantal analyses beÔnvloeden. Zo verstoren derivaten van antibiotica
het uitscheidingspatroon van aminozuren in urinemonsters in belangrijke
mate.
Het als anticonvulsief werkzame depakine induceert in veel patiŽnten
een verhoogde spiegel van glycine (en alanine) in serum, urine en liquor.
Ook geeft depakine in het profiel van de organische zuren een groot aantal
extra metabolieten en secundaire verhogingen van bekende metabolieten te
zien.
Paracetamol laat een verantwoorde kwantificering van de urine fenylalanine spiegel niet toe.
Allo-purinol kan het urinezuur gehalte
verlagen. Het is dus van groot belang bij de aanvraag een compleet
overzicht van de toegepaste medicatie te geven.
Vanzelfsprekend kan de voedingstoestand van de
patiŽnt ook een substantiŽle invloed op de resultaten van het metabole
onderzoek hebben. Bijvoorbeeld toepassing van parenterale voeding op de
aminozuurconcentraties.
Een duidelijk afwijkend excretiepatroon van
organische zuren kan veroorzaakt zijn door medium- chain-triglyceriden-voeding. Het oligosacchari-denpatroon vertoont
specifieke banden bij babyís gevoed met moedermelk en kan afwijkend zijn
bij het gebruik van voedingen die ongebruikelijke koolhydraten bevatten.
Het ontbreken van ketonlichamen in urine heeft hoge diagnostische waarde
indien de urine is verzameld tijdens een hypoglycemische periode. Van
groot belang is daarom bij hypoglycemie aan te geven of de urine verzameld
is in een hypoglycemi-sche periode.
Sommige diagnostische onderzoeken
dienen in nuchtere lichaamsvloeistoffen te worden uitgevoerd, andere niet.
Bij verdenking op bijvoorbeeld een vetzuuroxidatiestoornis verdient het
sterk de voorkeur de organische zuren in een portie nuchtere ochtendurine
te analyseren (patiŽnt niet laten vasten!).
Bij verdenking op een mitochondrieel defect is een urineportie van overdag juist beter.
Uiteraard zijn de verkregen resultaten het best te interpreteren onder
gestandaardiseerde condities.
Zijn toepassing van speciale diŽten of
medicatie niet (op korte termijn) te vermijden, dan behoren ze in ieder
geval vermeld te worden bij de aanvraag. Recent bij patiŽnt uitgevoerde
functie- of belastingstesten (b.v. met arginine) en andere onderzoeken (b.v.
met contrastvloeistof) kunnen direct de analyse storen of indirect via de
stofwisseling problemen geven. Ook deze items dienen daarom bij de
aanvraag genoteerd te worden.
Het metabole laboratorium dient van zijn kant er
zorg voor te dragen, dat elke belangrijke bevinding zo snel mogelijk
doorgegeven wordt aan de behandelend of aanvragend specialist. Dit betreft
zowel resultaten, die positief in de richting van een bepaalde diagnose
duiden, als resultaten die een diagnose uitsluiten. Hiermee kan immers
veel onnodig onderzoek voorkomen worden, alsook tijdig vervolgonderzoek
gepland worden. Terugkoppeling van de resultaten van het metabole
onderzoek naar de klinisch chemicus van het verwijzend ziekenhuis zal de
motivatie en coŲperativiteit van het betrokken chemisch laboratorium zeker
bevorderen.
Een veel voorkomend hiaat in de procedure van het metabole onderzoek is het terugkoppelen van de resultaten van door het
metabole laboratorium geadviseerde aanvullend onderzoek. Slechts
incidenteel is er feedback over een voorgestelde meting van bloed ammoniak
of lactaat spiegel of vragen over voeding, medicatie en dergelijke, die
belangrijk zijn voor de interpretatie van de bevindingen. Het zal dikwijls
zeer nuttig zijn voor de betrokken patiŽnt wanneer de resultaten met de
klinische en/of chemische metabole specialist besproken worden. Zo nodig
kan gezamenlijk een vervolgtraject uitgezet worden. Of kan de conclusie
getrokken worden, dat een stofwisselingsziekte mag worden uitgesloten.
Tenslotte
Onderzoek naar metabole ziekten kan, via
therapeutisch of preventief ingrijpen, veel schade en ellende voorkomen.
Het dient tijdig en zo effectief mogelijk te worden uitgevoerd.
Een wel
overwogen keuze van de uit te voeren onderzoeken is daarbij een
belangrijke stap. Het leeuwendeel van de aanvragen voor metabool onderzoek
zal zo algemeen gericht zijn, dat naast urine ook serum/plasma nodig zal
zijn.
Bij voorkeur worden beide lichaamsvochten in dezelfde periode
verzameld, zodat met name afwijkende concentraties in urine optimaal
geÔnterpreteerd kunnen worden. Indien zich bij patiŽnt een crisissituatie
voordoet is materiaal uit een dergelijke periode uitermate geschikt voor
biochemische diagnostiek. Een nadeel van zoín urinemonster kan zijn dat er
veel medicatie is toegepast.
Daarom dient, indien mogelijk, ook een portie
urine tijdens een medicamentvrije of medicamentarme periode verzameld te
worden. In principe voldoet een portie urine voor de meeste onderzoeken en
is een 24-uurs urine niet vereist.
Zeker in een acute klinische situatie
heeft het de voorkeur snel een portie urine bij het metabole laboratorium
aan te leveren dan te wachten tot een 24- uurs urine verkregen is.
Uitwisseling van medische, maar zeker ook van klinisch- chemische data, is
eveneens een essentiŽle voorwaarde voor een adequate uitvoering van meta-bool onderzoek.
Diverse aspecten van het totale diagnostische proces
kunnen verbeterd worden.
|