Historie:
-
Ureum werd voor het eerst in menselijke urine ontdekt door
Hillaire Marin Rouelle in 1773
-
In 1823 vonden Jean-Louis Prťvost en
Jean Baptiste Andrť Dumas
ureum in het bloed.
-
1820-29:
William Prout
prepareerde pure ureum uit urine en vond de correcte formule
-
Ureum wordt voor het eerst gesynthetiseerd in 1828 door
Friedrich Wohler.
-
1932:
Hans Adolf krebs
en Kurt Henseleit formuleerden een cyclisch proces
-
1952:
Sarah Ratner
en medewerkers ontdekken argininosuccinate
-
1955:
Mary Ellen Jones, Leonard Spector en
Fritz Albert Lipmann
ontdekken carbamyl phosphate
( cyclus is nu echt compleet )
Inleiding:
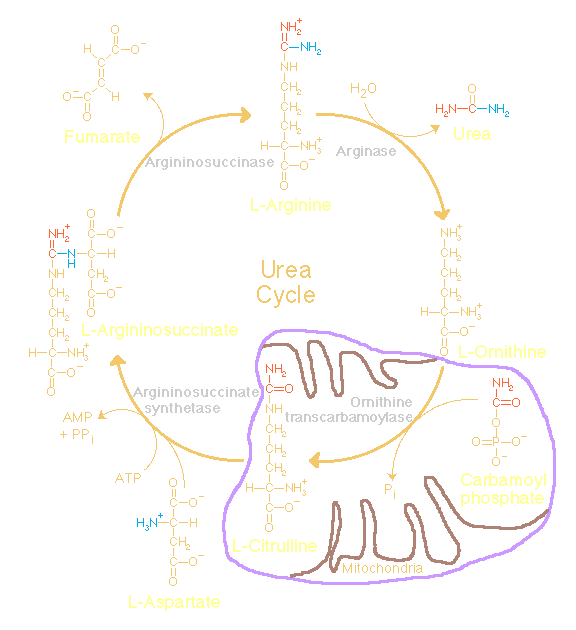
Ureum of carbamide ( NH2CONH2) , het diamide
van koolzuur , is een bijzondere stabiele verbinding met sterk
polaire eigenschappen . De oplosbaarheid van ureum in water is erg
groot. ( 1080 gram per 1 liter bij 20 0 C )
 CH4N2O CH4N2O
Ureum is het voornaamste eindproduct van de stikstofstofwisseling.
Ureum ontstaat in de lever en wordt door de nieren met de urine
uit het bloed verwijderd.
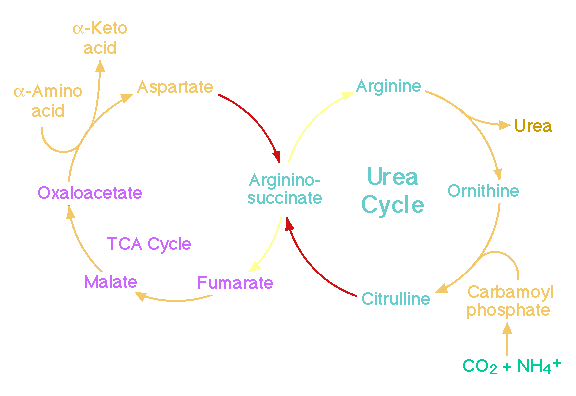
Bij de stofwisseling van eiwitten ( aminozuren ) komen kooldioxide
en ammoniak vrij. Ammoniak treedt de ureumcyclus binnen bij de
synthese van carbamoyl fosfaat en verlaat de cyclus bij de
omzetting van arginine tot ornithine.
De ureumcyclus produceert ureum uit ammoniak en kooldioxide en
stelt ons in staat via de urine overtollige stikstof uit te
scheiden in een niet giftige en goed oplosbare vorm. Deze stikstof
komt beschikbaar bij de afbraak van aminozuren, waarbij
asparaginezuur en glutaminezuur als laatste tussenschakel
fungeren.
Binnen de ureumcyclus zijn vijf enzymdefecten bekend welke allen
resulteren in hyperammoniŽmie. ( te hoog ammoniakgehalte van het
bloedserum ). Verstoring van de ureumcyclus veroorzaakt geen
acidose, ketose of hypoglycemie, maar manifesteert zich als een
direct toxisch effect van ammoniak op het centrale zenuwstelsel.
Duidelijke schade aan het brein wordt in die gevallen gezien
waarbij er geen ureum via de ureumcyclus gemaakt kan worden, of
waarbij ureum niet via de nieren verwijderd kan worden. Het gevolg
hiervan is een opbouw van ammonium ionen.
Naast het effect dat dit heeft op de zuurgraad van het bloed,
zullen de ammonium ionen de bloed-brein grens passeren en in het
brein omgezet worden in glutamaat. Deze omzetting wordt
gekatalyseerd door het enzym glutamate dehydrogenase , waarbij de
voorraad alpha-ketoglutaraat uitgeput zal raken.
Wanneer de aanwezige alpha-ketoglutaraat verdwenen is , zal ook
oxaloacetaat uitgeput raken , waarna uiteindelijk de
citroenzuurcyclus- activiteit zal stoppen.
Bij de afwezigheid van aerobische oxidatieve fosforylering en
afwezigheid van de citroenzuurcyclus-activiteit , zal er een
onherstelbare cel-schade optreden en zullen de neurale cellen
afsterven. Verder zal een toegenomen hoeveelheid glutamaat tot de
vorming van glutamine leiden. Door deze omzetting zal ook de
hoeveelheid glutamaat uitgeput raken. Daar glutamaat een
neurotransmitter is en tevens een voorloper voor de biosynthese
van gamma-aminobutyraat ( GABA : een andere neurotransmitter
) , zal een afname van glutamaat in het brein zowel een effect
hebben op de energie productie als op de neurotransmissie.
Neurotransmitter:
Chemische overdrachtsstoffen die de hersencellen gebruiken om
onderling signalen uit te wisselen. Dit gebeurt door een
interactie met een geschikte receptoren. Ze worden gemaakt in de
zenuwcellen en opgeslagen in kleine blaasjes in de uiteinden van
bepaalde zenuwvezels. Na een zenuwimpuls komen ze vrij in de
synapsspleet waar ze in interactie komen met verschillende
postsynaptische receptoren.
Toxisch effect van ammoniak:
De klinische kenmerken van een ammoniakintoxicatie zijn een
verlaging van het bewustzijn, desinteresse
in de omgeving, lethargie en braken. Dit kan gepaard gaan met een
verhoogde schedeldruk en hyperventilatie, met als gevolg een
respiratoire alkalose.
De hyperventilatie met respiratoire alkalose ontstaat doordat
ammoniak een stimulerend effect heeft op het ademhalingscentrum in
de hersenen. Door de stijging van de pH neemt het percentage
ammoniakgas
toe. Bij een pH van 7,6 is dit opgelopen tot 5% NH3.
Aangezien NH3 vrij over de bloed-hersenbarriŤre diffundeert, kan
de concentratie van ammoniak in het hersencompartiment sterk
toenemen. De toename van ammoniak in het hersencompartiment zal
nog sterker zijn als daarnaast ook nog sprake is van een absolute
toename van ammoniak in de circulatie.
Ammoniak activeert glutaminesynthetase in astrocyten, een
specifiek type hersencel, nauw verweven met
cerebellaire capillairen en venulae. Onder normale condities wordt
glutamine in de astrocyten gebruikt
als een organisch osmolyt om het celvolume constant te houden.
Met MRI is aangetoond dat er bij hoge spiegels van ammoniak een
toename is van glutamine in de astrocyten, dusdanig dat de
intracellulaire osmolaliteit stijgt naar een niveau waarbij
astrocytaire zwelling optreedt.
Door de volumetoename van de astrocyten worden de capillairen en
de venulae samengedrukt, waardoor de schedeldruk toeneemt en het
risico op een cerebraal oedeem verhoogd is.
Reacties:
De ureumcyclus is enzym gekatalyseerd waarbij de volgende enzymen
een rol spelen:
-
Carbamoyl-phosphate synthetase ( ammonia )
ExPASy: EC 6.3.4.16
Synoniemen voor dit enzym:
Carbamoyl-phosphate synthetase (ammonia);
Carbamoyl-phosphate synthetase I; CPS I;
Carbamoylphosphate synthetase (ammonia);
Carbon-dioxide--ammonia ligase.
Dit enzym katalyseert de
omzetting van kooldioxide, ammoniak en ATP tot carbamoyl
phosphate , waarbij N-acetylglutamaat als activator optreedt.
2 ATP + NH3 + CO2 +
H2O <=> 2 ADP + phosphate + carbamoyl
phosphate
2C10H16N5O13P3
+ NH3 + CO2 <=>
2C10H15N5O10P2
+ H3O4P +
CH4NO5P
-
Ornithine carbamoyltransferase
ExPASy:
EC 2.1.3.3
Synoniemen voor dit enzym: Ornithine transcarbamylase; Citrulline
phosphorylase; OTCase; OTC.
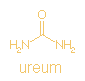
Carbamoyl phosphate + L-ornithine <=> phosphate +
L-citrulline
CH4NO5P +
C5H12N2O2
<=> H3O4P +
C6H13N3O3
-
Argininosuccinate synthetase
ExPASy:
EC 6.3.4.5
Synoniemen voor dit enzym: Argininosuccinate
synthetase; Citrulline--aspartate ligase; Arginine
succinate synthetase
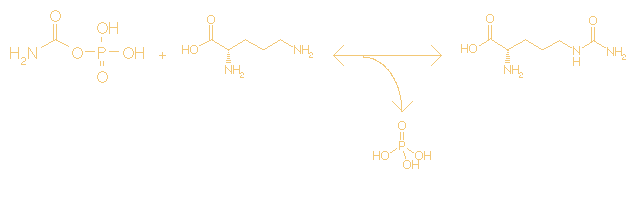
ATP + L-citrulline + L-aspartate <=> AMP + diphosphate
+ L-argininosuccinate
C10H16N5O13P3 +
C6H13N3O3
+ C4H7NO4 <=>
C10H14N5O7P
+ H4O7P2 +
C10H18N4O6
-
Argininosuccinate lyase
ExPASy:
EC 4.3.2.1
Synoniemen voor dit enzym:
Arginosuccinase
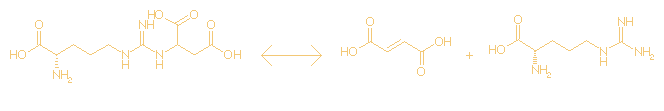
N-(L-arginino)succinate <=> fumarate + L-arginine
C10H18N4O6
<=> C4H4O4 +
C6H14N4O2
-
Arginase
ExPASy:
EC 3.5.3.1
Synoniemen voor dit enzym: Arginine
amidinase; Canavanase
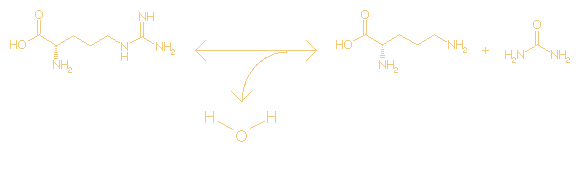
L-arginine + H2O <=> L-ornithine + urea
C6H14N4O2 + H2O <=>
C5H12N2O2
+ CH4N2O
De netto reactie voor de synthese van ureum is:
CO2 + NH4+ + 3ATP + aspartate
+ 2H2O > ureum + 2ADP + 2Pi
+ AMP + PPi + fumarate
De primaire ureumcyclus defecten:
( De primaire
hyperammoniŽmieŽn ):
-
Classic Citrullinemia ( argininosuccinaat
synthetase deficiŽntie: citrullinemie )
Synoniemen; Argininosuccinate synthetase
deficiŽntie; ASS deficiency;
Citrullinuria; Citrullinemia Type I
OMIM:
215700
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy:
EC 6.3.4.5 Argininosuccinate synthetase
e-Medicine:
Citrullinemia
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle Disorders Foundation:
http://www.nucdf.org
-
Hyperammonemia due to Ornithine Transcarbamylase
Deficiency
( Ornithine carbamyl transferase deficiŽntie:
OCT-deficiŽntie )
Synoniemen: Ornithine carbamoyltransferase deficiency ; OCT
deficiency; OCTD
OMIM:
311250
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy:
EC 2.1.3.3
Ornithine carbamoyltransferase
e-Medicine:
Ornithine Transcarbamylase Deficiency
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle
Disorders Foundation:
http://www.nucdf.org
-
Argininemia ( Arginase deficiŽntie:
hyperargininemie )
Synoniemen: Arginase deficiŽntie; ARG 1
deficiency; Argininemia ; Hyperargininemia
OMIM:
207800
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy:
EC 3.5.3.1 Arginase
e-Medicine:
Arginase Deficiency
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle
Disorders Foundation:
http://www.nucdf.org
-
Hyperammonemia due to N-acetylglutamate synthetase
( N-acetylglutamaat synthetase deficiŽntie )
Synoniemen: N-acetylglutamate synthetase
deficiŽntie; NAGS defeciciency
OMIM:
237310
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy:
EC 2.3.1.1 Amino-acid N-acetyltransferase
e-Medicine:
N-Acetylglutamate Synthetase Deficiency
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle Disorders Foundation:
http://www.nucdf.org
-
Argininosuccinic aciduria
(Argininosuccinaat lyase deficiŽntie: argininosuccinaat
acidurie )
Synoniemen: Argininosuccinate lyase deficiŽntie;
ASL deficiency; Argininosuccinase
Deficiency;Argininosuccinic acid lyase deficiency
OMIM:
207900
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy:
EC 4.3.2.1 Argininosuccinate lyase
e-Medicine:
Argininosuccinate Lyase Deficiency
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle Disorders Foundation:
http://www.nucdf.org
-
Hyperammonemia due to Carbamoylphosphate Synthetase
I deficiency
( Carbamylfosfaat synthetase deficiŽntie: CPS deficiŽntie
)
Synoniemen: Carbamoylphosphate synthetase I
deficiency; CPS1 deficiency
OMIM:
237300
OMIM:
Clinical Synopsis ( klinisch overzicht )
ExPASy: EC 6.3.4.16
Carbamoylphosphate synthetase
e-Medicine:
Carbamoyl Phosphate Synthetase Deficiency
e-Medicine:
Hyperammonemia
GeneReviews:
Urea Cycle Disorders Overview
National Urea Cycle Disorders Foundation:
http://www.nucdf.org
De secundaire hyperammoniŽmieŽn:
Bij de defecten met een secundaire hyperammoniŽmie bestaat er een
gebrek aan intermediairen van de ureumcyclus, waardoor de
ureumcyclusstofwisseling secundair gestoord is:
Behalve door erfelijke stofwisselingsziekten die primair of
secundair de ureumcyclusfunctie verstoren, kan hyperammoniŽmie
worden veroorzaakt door onder andere leverfunctiestoornissen ten
gevolge van circulatiestoornissen (hypoxie / shock ), sommige
medicijnen en exogene intoxicaties.
HyperammoniŽmie is een levensbedreigende toestand en de behandeling moet
zo snel mogelijk gestart worden.

|
Introduction in Nitrogen Metabolism and the Urea Cycle
|

|
The National Urea Cycle Disorders Foundation
|
Ned Tijdschr Klin Chem 1998; 23: 214-218
>Artikelen
Ammoniak in bloed: indicaties, klinische betekenis en
toepassing van ammoniakbepalingen
J.R. HUIZENGA1, C.H. GIPS2 en A. TANGERMAN3
In de (poli)kliniek wordt ammoniak vaak geassocieerd met het
voorkomen van leverziekte of met erfelijke metabole ziekten.
Soms kan de klinische interpretatie van een ammoniakuitslag in
bloed of plasma moeilijk zijn. Een standaard referentiemethode
voor het bepalen van ammoniak in bloed of plasma is (nog) niet in
de literatuur beschreven.
Ammoniakbepalingen worden bij volwassenen meestal aangevraagd bij
leverfalen, (sub-klinische) leverencefalopathie of encefalopathie
door onbekende oorzaak, (pre)levercoma en bij kinderen met
verdenking op (erfelijke) metabole ziekten met afwijkingen in de
ureumcyclus en leverfalen.
Om een ammoniakuitslag goed te kunnen beoordelen is inzicht in de
bepalingsmethodiek en in het ammoniakmetabolisme van groot belang.
Bij het bestuderen van leverziekte kunnen veneuze ammoniakspiegels
een vertekend beeld geven, vanwege de bijdrage van ammoniak
afkomstig van andere organen aan veneus bloed. De arteriŽle
ammoniakconcentratie is voornamelijk afkomstig van de lever en is
daarom een betere maat voor de bepaling van de functie ervan. In
plaats van arterieel bloed kan capillair bloed uit de oorlel een
uitstekend alternatief zijn.
Voor de bepaling hiervan is een methode nodig die weinig bloed
nodig heeft (bijvoorbeeld d.m.v. de Blood Ammonia Checker - BAC -
II; 20 Ķl vol bloed).
Methodologisch kan bij geselecteerde patiŽntengroepen met de
indofenolmethode onderscheid worden gemaakt tussen een endogeen en
exogeen levercoma en kan de enzymatische methode als
onderzoekstest voor het aantonen van levercirrose dienen.
Met de BAC II kan onderscheid worden gemaakt tussen patiŽnten met
leverencefalopathie en neurologische encefalopathie en tussen
gezonden en patiŽnten met leverziekte en/of leverencefalopathie.
Bij simultaan gebruik van de BAC II en de indofenolmethode kan het
verschil tussen beide worden verklaard door de interferentie
van aminozuren bij de indofenolmethode (IFI). Deze methode kan bij
patiŽnten met leverencefalopathie de ernst van de onderliggende
leverziekte aangeven.
Voor de routine heeft de bepaling van ammoniak in bloed met de BAC
II de voorkeur.
In de klinische praktijk worden ammoniakbepalingen in bloed en/of
plasma meestal aangevraagd om na te gaan of leverziekte de oorzaak
is bij (pre)comateuze patiŽnten en om een indruk te krijgen van de
ernst van leverencefalopathie bij leverpatiŽnten (1).
Ook kan een ammoniakbepaling worden aangevraagd om de behandeling
van een leverziekte te volgen of om de functie van een nieuwe
lever na levertransplantatie te controleren (2).
Ammoniakbepalingen bij kinderen worden vaak aangevraagd bij
erfelijke metabole ziekten (3).
In het menselijk lichaam wordt het ammoniumion gevormd uit
ammoniakgas en vice versa in een evenwichtsreactie: NH3 (gas) + H+
! NH4 +, met een pKa van ongeveer 9,2 (4).
Bij een fysiologische pH van 7,3 is 99 % in de vorm van HN4 + en 1
% als vrij gas aanwezig.
In dit artikel wordt met ammoniak de totale hoeveelheid NH3 + NH4
+ bedoeld.
Naast pathofysiologische mechanismen kunnen methodologische
verschillen variaties veroorzaken in het ammoniakgehalte van
bloed.
Verschillende bepalingsmethoden kunnen resulteren in verschillende
normaalwaarden (5,6). In dit artikel wordt een overzicht gegeven
van arterieel versus veneus ammoniak in bloed voor het bepalen van
de functie van de lever. De indicaties voor het bepalen van
ammoniak in bloed of plasma en de klinische betekenis van ammoniak
in bloed in relatie tot methoden die vaak worden gebruikt, worden
besproken.
Arterieel versus veneus ammoniak in bloed voor het bepalen van
de functie van de lever
Het ammoniakgehalte van bloed bij de mens is onder normale
fysiologische omstandigheden vrij stabiel. In gezonde personen is
er een evenwicht tussen de productie en uitscheiding van ammoniak.
Gedetailleerde informatie over de ammoniakbijdrage van elk orgaan
(systeem) afzonderlijk kan worden verkregen door het arteriŽle en
veneuze verschil tussen het ammoniakgehalte over een orgaan te
meten, tezamen met de bloedstroom door het orgaan.
Bij het bestuderen van leverziekte kunnen veneuze ammoniakspiegels
een vertekend beeld geven. Andere organen kunnen voor een
belangrijk deel ook bijdragen aan veneus ammoniak. Zo verhogen
bewegende spieren het ammoniakgehalte van bloed, terwijl rustende
spieren ammoniak metaboliseren en dus verlagen.
Daar de lever het enige orgaan is dat de ammoniakverwijderende
ureumcyclus bevat, is het ammoniakgehalte van de levervene het
laagste en bepaalt de lever uiteindelijk het arteriŽle
bloedammoniakgehalte (7).
Bij het bestuderen van leverziekte moeten daarom arteriŽle
ammoniakspiegels gemeten worden om de bijdrage van de lever aan
het ammoniakmetabolisme vast te stellen.
Bloed
Onder normale omstandigheden is het ammoniakgehalte van rode
bloedcellen (RB) hoger dan van plasma. Ongeveer 75 % van het
ammoniak in volbloed is aanwezig in RB (8).
Bloed van een normale persoon bevat totaal ongeveer 150 Ķmol
ammoniak (d.w.z. 30 Ķmol/l in 5 l bloed; 115 Ķmol in RB en 35 Ķmol
in plasma).
Daar de pH in RB lager is dan in plasma zou passieve diffusie van
ammoniak een rol kunnen spelen in de verdeling van ammoniak tussen
RB en plasma. Normaal worden er tussen bloed en plasma geen of
geringe verschillen gevonden in ammoniakspiegels (4).
In de literatuur worden meestal de (geautomatiseerde)
enzymatische, colorimetrische of BAC II (microdiffusie) methoden
voor routine en research doeleinden gebruikt (6). Wanneer een
ammoniakmethode ter beschikking staat die weinig bloed of plasma
nodig heeft kan capillair bloed gebruikt worden (BAC II, 20 Ķl
volbloed) (9). Capillair bloed uit een vingerprik is o.a. wegens
verontreiniging met zweet ongeschikt (10,11).
Wij hebben een vergelijkend onderzoek verricht naar het
ammoniakgehalte van capillair bloed uit een oorlel en simultaan
afgenomen arterieel bloed (12). De waarden in een gezonde
controlegroep en in een patiŽntengroep zonder en met leverziekte
werden met elkaar vergeleken. Het ammoniakgehalte in bloed uit de
oorlel verschilde niet met dat van arterieel bloed in de twee
patiŽntengroepen. De ammoniakconcentratie van bloed uit de oorlel
in de totale controlegroep (n=124, spreiding 7-45 Ķmol/l, mediaan
20 Ķmol/l) komt overeen met eerder gepubliceerde referentiewaarden
(13). De correlatie tussen het ammoniakgehalte van bloed uit de
oorlel en arterieel bloed was goed en de conclusie was dat
capillair bloed een goed alternatief is voor arterieel bloed.
Bij kinderen (neonaten) is een goede correlatie gevonden tussen
het ammoniakgehalte van plasma uit een hielprik en arterieel
plasma (14). Bij kinderen (en neonaten) wordt dan ook bij voorkeur
bloed uit de oorlel afgenomen voor het bepalen van ammoniak.
Indicaties voor het bepalen van ammoniak in het bloed
Onder pathofysiologische omstandigheden kunnen verhoogde
ammoniakspiegels in bloed voorkomen bij een aangetaste,
verminderde functie van de lever, bij afwijkingen van de
ureumcyclus, bij een verandering in aminozuurpatroon of organische
zuren en incidenteel bij enige zeldzaam voorkomende ziekten (tabel
1) (3).
Erfelijke metabole ziekten, zoals een gebrek aan
ornithinecarbamyltransferase met verhoogde spiegels van citrulline
en argininosuccinaat (ureumcyclus), zijn zeldzaam en komen meestal
voor bij pasgeborenen en kinderen (15).
Bij pasgeborenen, gedurende de eerste 48 uur, kan het vinden van
een verhoogde ammoniakwaarde van eminent belang zijn voor de
opsporing van bovengenoemde afwijkingen (16).
Bij zowel kinderen als volwassenen die intraveneuze voeding
krijgen zijn verhoogde ammoniakspiegels geconstateerd. De
etiologie is onbekend (17).
In de literatuur zijn bij pasgeborenen en kinderen met asfyxie,
infecties of sepsis eveneens verhoogde ammoniakspiegels
gepubliceerd (18-20) evenals bij kinderen en volwassenen met
Reye's syndroom (21), na therapie met natriumvalproaat (22), met
urineweginfectie (23) en met leukemie (24).
Bij patiŽnten met neuropsychiatrische symptomen van onduidelijke
oorsprong is het wenselijk ammoniak te bepalen om onderliggend
leverlijden uit te sluiten (25).
De meest voorkomende indicaties voor het bepalen van een nuchtere
ammoniakspiegel in arterieel bloed en/of plasma bij volwassenen,
kinderen en pasgeborenen zijn in tabel 2 vermeld. In het algemeen
is de klassieke indicatie voor een nuchtere ammoniakbepaling om
leverziekte uit te sluiten als oorzaak bij (pre)comateuze
patiŽnten, voor het aantonen van leverencefalopathie of bij het
vervolgen van een behandeling bij leverpatiŽnten.
Het bepalen van ammoniak voor en direct na een levertransplantatie
kan inzicht geven in de metabole, functionele werking van een
nieuwe lever (2).
In sommige gevallen en eventueel afhankelijk van de methodologie
kan het ammoniakgehalte normaal zijn. Een orale of rectale
ammoniakbelastingstest kan hier uitkomst bieden (26).
De meest voorkomende indicatie bij kinderen (en neonaten) is een
erfelijke metabole ziekte met afwijkingen in de ureumcyclus.
Gezien de spierbijdrage aan het ammoniakmetabolisme bestaat er
geen indicatie om ammoniak in perifeer, veneus bloed te bepalen
(7). Bij erfelijke metabole ziekten moeten naast de bepaling van
ammoniak ook andere biochemische parameters zoals aminozuren en
organische zuren worden bepaald (3).


Enige klinische toepassingen van ammoniakmethoden bij patiŽnten
met leverziekte
Naast pathofysiologische mechanismen kunnen methodologische
verschillen het arteriŽle ammoniakgehalte van bloed en/of plasma
van leverpatiŽnten eveneens beÔnvloeden. Verschillende methoden
kunnen verschillende (referentie)waarden opleveren.
Uit de literatuur is bekend dat de directe indofenolmethode voor
volbloed (27) geremd wordt door aromatische aminozuren (28).
Verhoogde aromatische aminozuren (tryptofaan, tyrosine,
fenylalanine) worden met name gevonden bij patiŽnten met ernstige
leverencefalopathie (eindstadium leverziekte) of acuut fulminant
leverfalen (29). Deze remming wordt niet gevonden bij het gebruik
van de Blood Ammonia Checker (BAC) I (30) of BAC II (9).
In de kliniek kunnen dan ook de verschillen tussen de methoden
worden toegepast. De enzymatische methode voor plasma kan worden
gestoord door hemolytische, troebele of (donker)gele serummonsters
(31).
Indofenolmethode
Wanneer alleen de directe indofenolmethode wordt gebruikt is het
mogelijk onderscheid te maken tussen een endogeen (vanuit de lever
als gevolg van acuut leverfalen) en een exogeen porta-systemische
levercoma (elektrolytencoma).
Bij een endogeen levercoma worden ten gevolge van verhoogde
aromatische aminozuren vaak erg lage ammoniakwaarden (soms nul) in
het bloed gevonden, terwijl een hoog ammoniakgehalte in bloed op
een exogeen levercoma wijst met een betere prognose. Dit
onderscheid kan niet gemaakt worden op basis van
elektro-encefalografisch onderzoek (25).
Het bepalen van ammoniak met de indofenolmethode vlak voor een
levertransplantatie en direct na recirculatie kan inzicht
verschaffen over het functioneren van de nieuwe lever (2).
Bij 17 patiŽnten uit de beginfase van de levertransplantaties in
Groningen (1979-1981) werd gedurende de vier episoden van de
operatieprocedure (donormelding: I; vlak voor de anhepatische
fase: II; tijdens de anhepatische fase: III en ťťn uur na
implantatie van een nieuwe lever: IV) in arterieel bloed het
ammoniakgehalte bepaald. Als referentie werd een groep van 16
patiŽnten zonder leverziekte gebruikt.
Het ammoniakgehalte in de stadia I, II en III was hoger dan dat
bij de referentiegroep. Het gehalte in stadium IV verschilde niet
van het gehalte van de referentiegroep, hetgeen betekende dat
binnen 1 uur na implantatie van een nieuwe lever en met herstelde
bloedcirculatie het ammoniakgehalte genormaliseerd was.
In een longitudinale analyse bleek dat de concentratie tijdens
stadium III hoger en in stadium IV lager was dan dat in de stadia
I en II.
Enzymatisch, indofenolmethode en BAC I
Het bepalen van een nuchtere ammoniakspiegel met een enzymatische
methode bij leverpatiŽnten kan een bruikbare onderzoekstest zijn
voor het aantonen van cirrose (5).
Bij 106 niet encefalopathische leverpatiŽnten (56 hadden cirrose
en 50 geen cirrose) en 51 controlepatiŽnten zonder leverziekte
werd simultaan met een enzymatische methode voor plasma (32), met
de indofenolmethode (33) en met de BAC I voor volbloed (30) in
arteriŽle monsters het ammoniak bepaald.
De patiŽnten met cirrose hadden met de enzymatische methode en met
de BAC I hogere ammoniakwaarden dan de niet-cirrose groep en dan
de controlegroep. Bovendien kon met de enzymatische methode de
niet-cirrose groep van de controlegroep worden onderscheiden. De
indofenolmethode kon geen onderscheid maken tussen leverpatiŽnten
en de controlegroep.
Indofenolmethode en BAC II
In een studie om leverencefalopathie met behulp van
ammoniakmetingen vast te stellen werd arterieel ammoniak simultaan
bepaald met de indofenolmethode (33) en de BAC II (9) bij
leverpatiŽnten met (n=70) en zonder (n=55) leverencefalopathie. De
resultaten werden vergeleken met die van 39 patiŽnten zonder
leverziekte en 13 patiŽnten met neurologische encefalopathie
zonder leverziekte (34).
Eerder was in ons laboratorium waargenomen dat bij patiŽnten met
ernstig leverfalen de indofenol reactie soms totaal geremd werd en
een in vitro onderzoek had aangetoond dat deze remming veroorzaakt
werd door aromatische aminozuren (28). Deze aminozuren kunnen in
verhoogde mate aanwezig zijn in bloed van patiŽnten met
leverencefalopathie.
Het verschil tussen de BAC II- en ammoniakwaarden met de
indofenolmethode werd aangeduid als interferentie met de
indofenolreactie (IFI) en uitgedrukt in Ķmol
-N/l.
Terwijl in de controlegroepen de verschillen tussen de waarden met
de BAC II- en de indofenolmethode klein of afwezig waren, bleven
de indofenolwaarden in de patiŽnten met leverziekte achter bij de
BAC II waarden.
Bij toenemende BAC II spiegels nam IFI ook toe, vermoedelijk als
gevolg van een toename van de aminozuren die de indofenolmethode
remmen. Het was mogelijk om met de BAC II en IFI lever- en
neurologische encefalopathie patiŽnten van elkaar te
onderscheiden.
In deze studie werd met de indofenolmethode geen verschil gevonden
tussen de controlegroep en de leverpatiŽnten. Door gebruik te
maken van beide methoden en IFI werd een verschil tussen patiŽnten
met en zonder leverencefalopathie gevonden (34).
Conclusies
Veel organen of orgaansystemen spelen een belangrijke rol bij het
in stand houden van het arteriŽle ammoniakgehalte van bloed. Het
berekenen van de bijdrage van elk orgaan(systeem) afzonderlijk is
gecompliceerd doordat zowel onder normale als pathofysiologische
omstandigheden weinig kwantitatieve gegevens bekend zijn (7).
Bij het verwijderen van ammoniak speelt de lever een cruciale rol.
Tijdens leverfalen is de ontgiftigingsroute vaak aangetast. De
mate en ernst van aantasting met betrekking tot ammoniakverwerking
is moeilijk te kwantificeren.
Wanneer een BAC II ter beschikking staat kan bij zowel volwassenen
als kinderen het ammoniakgehalte van capillair oorlelbloed worden
bepaald. Het verkrijgen van bloed uit een oorlel kan bij het bed
plaatsvinden, is patiŽntvriendelijk en een kwantitatieve uitslag
kan binnen 5 minuten verkregen worden.
Leverfalen, leverencefalopathie, encefalopathie door onbekende
oorzaak en (pre)levercoma zijn bij volwassenen de belangrijkste
reden om een arteriŽle ammoniakbepaling aan te vragen.
Kinderen en/of pasgeborenen met verdenking op metabole ziekte(n)
met afwijkingen in de ureum- en/of citroenzuurcyclus of leverfalen
vormen de belangrijkste indicatie voor het bepalen van een
ammoniakspiegel.
Bij volwassenen en kinderen kan een ammoniakbepaling worden
gebruikt voor het vervolgen van de ziekte of het effect van de
therapie.
Indien in een ziekenhuis meerdere methoden voor het bepalen van
ammoniak in arterieel bloed beschikbaar zijn kan met ťťn methode
of met een combinatie van methoden bepaalde patiŽntengroepen
worden onderscheiden.
Met de indofenolmethode kan bijvoorbeeld onderscheid worden
gemaakt tussen een endogeen of exogeen levercoma en de
enzymatische methode kan als onderzoekstest worden gebruikt voor
het aantonen van levercirrose (5).
Met de BAC II kan zowel onderscheid worden gemaakt tussen
patiŽnten met leverencefalopathie en neurologische encefalopathie
evenals tussen gezonden en patiŽnten met leverziekte of
leverencefalopathie (34). Het bepalen van ammoniak in bloed met de
BAC II voor zowel routine als research doeleinden heeft dan ook de
voorkeur.
In waterige biologische vloeistoffen die geen of nauwelijks
aminozuren bevatten door o.a. veelvuldige verdunning (liquor,
speeksel, zweet) kan de indofenolmethode uitstekend worden
gebruikt. Wanneer de remming van de indofenolmethode door
aromatische aminozuren in bloed van leverpatiŽnten wordt
gevalideerd kan een combinatie van de BAC II en indofenolmethode
informatie geven over de ernst van de onderliggende leverziekte en
kan vervolgens de metabole functie van de lever worden vervolgd
tot bijvoorbeeld het tijdstip voor een levertransplantatie.
Literatuur
-
Conn HO, Bircher J (eds). Hepatic encephalopathy: management
with lactulose and related carbohydrates. Medi- Ed Press, East
Lansing, Michigan, USA, 1989.
-
Huizenga JR, Gips CH, Krom RAF. Arterial blood ammonia during
orthotopic liver transplantation as an indicator of waste
elimination by the new liver. Clin Chim Acta 1995; 239:
103-106.
-
Green A. When and how should we measure plasma ammonia? Ann
Clin Biochem 1988; 25: 199-209.
-
Gips CH. Ammonia in clinical medicine. I. Some aspects of
ammonia metabolism. Folia Med Neerl 1970; 13: 14-21.
-
Huizenga JR, de Bruijn KM, Gips CH. Can a single fasting
arterial ammonia predict the presence of cirrhosis? In:
Advances in ammonia metabolism and hepatic encephalopathy.
Soeters PB, Wilson JHP, Meijer AJ, Holm E (eds). Elsevier
Science Publishers B.V., Amsterdam, The Netherlands, 1988:
593-600.
-
Huizenga JR. Ammonia in human fluids. Methodology and clinical
applications. Thesis, University of Groningen,The Netherlands,
1995.
-
Huizenga JR, Gips CH, Tangerman A. The contribution of various
organs to ammonia formation: a review of factors determining
the arterial ammonia concentration. AnnClin Biochem 1996; 33:
23-30.
-
Conn HO. Studies on the origin and significance of blood
ammonia. II. The distribution of ammonia in whole blood plasma
and erythrocytes of man. Yale J Biol Med 1966; 39: 38-53.
-
Huizenga JR, Tangerman A, Gips CH. A rapid method for blood
ammonia determination using the new blood ammonia checker
(BAC) II. Clin Chim Acta 1992; 210: 153-155.
-
Brusilow SW, Gordes EH. Ammonia secretion in sweat. Am J
Physiol 1968; 214: 513-517.
-
Quero JC, Huizenga JR, Chamuleau RAFM, Blijenberg BG, Gips CH,
Schalm SW. Determination of ammonia in capillary and arterial
blood simultaneously using the Blood Ammonia Checker II. In:
Advances in hepatic encephalopathy and metabolic nitrogen
exchange. Capocaccia L, Merli M, Riggio O (eds). CRC Press,
Boca Raton, 1995: 414-419.
-
Huizenga JR, Gips CH, Conn HO, Jansen PLM. Determination of
ammonia in ear-lobe capillary blood is an alternative to
arterial blood ammonia. Clin Chim Acta 1995; 239: 65-70.
-
Huizenga JR, Tangerman A, Gips CH. Determination of ammonia in
biological fluids. Ann Clin Biochem 1994 31: 529-534.
-
Schwartz JB, Cheng MH, Ramos AD, Merritt RJ, Platzker ACG.
Capillary plasma ammonia concentration in neonates receiving
total parenteral nutrition. Comparison with arterial and
venous concentrations. J Perinatol 1990; 10: 376-379.
-
Leonard JV. Hyperammononaemia in childhood. In: Chemical
pathology and the sick child. Clayton BE (ed). Blackwell,
Oxford, 1984: 96-119.
-
Ballard RA, Vinocur B, Reynolds JW, Wennberg RP, Merritt A,
Sweetman L, Nyhan WL. Transient hyperammonemia of the preterm
infant. New Engl J Med 1978; 299: 920-925.
-
Seashore JH, Seashore MR, Riely C. Hyperammonaemia during
total parenteral nutrition in children. J Parenteral Ext Nutri
1982; 6: 114-118.
-
Goldberg RN, Cabal LA, Sinatra FR, Plajstek CE, Hodgman JE.
Hyperammonemia associated with perinatal asphyxia. Pediatrics
1979; 64: 336-341.
-
Barnes PM, Wheldon DB, Eggerding C, Marshall WC, Leonard JV.
Hyperammonaemia and disseminated herpes simplex infection in
the neonatal period. Lancet 1982; ii:1362-1363.
-
Beddis IR, Hughes EA, Rosser E, Fenton JCB. Plasma ammonia
levels in newborn infants admitted to an intensive care baby
unit. Arch Dis Child 1980; 55: 516-520.
-
Tarlow M. Reye's syndrome and aspirin. Br Med J 1986;
292: 1543-1544.
-
Coulter DL, Allen RJ. Hyperammonaemia with valproic acid
therapy. J Pediatr 1981; 99: 317-319.
-
Drayna CJ, Titcomb CP, Varma RR, Soergel KH. Hyperammonaemia
encephalopathy caused by infection in a neurogenic bladder. N
Engl J Med 1981; 304: 766-768.
-
Watson AJ, Karp JE, Gordon Walker W, Chambers T, Risch VR,
Brusilow SW. Transient idiopathic hyperammonaemia in adults.
Lancet 1985; ii: 1271-1274.
-
Gips CH. Ammonia in clinical medicine. II. Diagnostic ammonia
tests. Folia Med Neerl 1970; 13: 21-26.
-
Gips CH. Diagnostische ammoniakproeven. Thesis, University of
Groningen, The Netherlands, 1968.
-
Gips CH, Wibbens-Alberts M. Ammonia determination in blood
using the TCA direct method. Clin Chim Acta 1968; 22:
183-186.
-
Gips CH, Reitsema A. Influence of non-protein nitrogen
substances on the indophenol reaction. Clin Chim Acta1971; 33:
257-259.
-
Rosen HM, Yoshimura N, Hodgman JM, Fischer JE. Plasma amino
acid patterns in hepatic encephalopathy of differing etiology.
Gastroenterology 1977; 72: 483-487.
-
Huizenga JR, Gips CH. Determination of blood ammonia using the
ammonia checker. Ann Clin Biochem 1983; 20: 187-189.
-
Da Fonseca-Wollheim F. Ultrafiltrate analysis confirms the
specificity of the selected method for ammonia determination.
Eur J Clin Chem Clin Biochem 1992; 30: 15-19.
-
Da Fonseca-Wollheim F. Direkte Plasmaammoniakbestimmung ohne
Enteiweissung. J Clin Chem Clin Biochem 1973; 11: 426-431.
-
Huizenga JR, Gips CH. Measurements of ammonia in blood. A
comparison of three analytical methods. Tijdschr NVKC 1985;
10: 105-107.
-
Huizenga JR, van Dam GM, Gips CH. Arterial ammonia with Blood
Ammonia Checker II and with indophenol reaction to assess
presence of hepatic encephalopathy. ClinChim Acta 1996; 252:
73-82.
Ned Tijdschr Klin Chem 1998, vol. 23, no. 5

|
Hoofdmenu |
|