|
Enzymen
Definitie:
Enzym (Grieks: enzym; en = in, zumŤ = zuurdeeg, gist; enzym =
in zuurdeeg); de oude naam voor enzym is
"ferment".
( Ferment: de stof die gisting veroorzaakt =enzym; Fermentatie =
gisting ).
Op een kleine groep RNA moleculen na, zijn enzymen eiwitten die
werken als een biologische katalysator, dwz. versneller van
(bio)chemische processen die zich in levende organismen
afspelen.
( RNA: ribonucleic acid - ribonucleÔnezuur ).
Een groot deel van de kleine groep RNA moleculen ( ribozymen of
RNA enzymen) katalyseren of de eigen splitsing of de splitsing
van andere RNA's, maar ze kunnen ook de
aminotransferase-activiteit van ribosomen activeren.
Wetenschappers hebben in het laboratorium zelfs ribozymen kunnen
produceren die onder specifieke condities in staat zijn de eigen
synthese te katalyseren.
Enkele bekende ribozymen zijn: ribonuclease; groep I en
groep II introns; hammerhead, hairpin and hepatitis delta virus (HDV) ribozymes (
Human Molecular Genetics
).
Historie:
-
Ongeveer 10.000 voor Christus: Fermentatie; het proces dat
tot de ontdekking van enzymen leidde.
-
2000 voor Christus: Egyptenaren en
Sumerianen ontwikkelen fermentatie voor gebruik in brouwen,
brood bakken en het maken van kaas.
-
800 voor Christus: de magen van kalveren en het enzym
chymosine werden gebruikt om kaas te maken.
-
Middeleeuwen: alchemisten identificeren alcohol als product
van fermentatie.
-
Alcoholische fermentatie is ontegenzeggelijk de oudste
bekendste enzym reactie. Deze en andere fenomenen werden tot
1857 gedacht spontane reacties te zijn. In 1857 concludeerde
de Franse chemicus
Louis Pasteur
dat alcoholische fermentatie wordt gekatalyseerd door
"fermenten" en alleen plaatsvindt in de aanwezigheid
van levende cellen. Vervolgens echter, ontdekte de Duitse
chemicus
Eduard Buchner
in 1897 dat een celvrij extract van gist alcoholische
fermentatie kan veroorzaken. De oude puzzel was nu
opgelost....; de gistcellen produceren het enzym en het enzym
laat de fermentatie verlopen.
|

|

|
|
Louis Pasteur
|
Eduard Buchner
|
-
In 1833 rapporteerde Anselme Payen ( 1795 Parijs -
1871 Parijs ) samen met de chemicus en farmacoloog
Jean- FranÁois Persoz (1805 Cortaillod - 1868 Paris)
de winning van een substantie uit een malt-extract die de
eigenschap bezat zetmeel om te zetten in glucose. Hij noemde
deze substantie
"diastase " ( Grieks: diastasis = scheiden
).
Diastase was het eerste enzym dat in geconcentreerde
vorm geprepareerd werd.
Onder diastase wordt tegenwoordig verstaan: alpha-amylase,
beta-amylase en gamma-amylase.
α-Amylase
EC 3.2.1.1
( officiŽle naam )
Alternatieve namen:
1,4-alpha-D-glucan glucanohydrolase;
Glycogenase.
β-amylase EC 3.2.1.2
Alternatieve namen:
1,4-alpha-D-glucan maltohydrolase; Glycogenase; Saccharogen amylase
Glucan 1,4-alpha-glucosidase
EC 3.2.1.3
alternatieve namen: γ-amylase; 1,4-alpha-D-glucan glucohydrolase; Lysosomal
alpha-glucosidase

Anselme Payen
-
De Zweedse chemicus
Jons Jakob Berzelius
(1779Ė1848) verrichtte reeds in 1835 een van de eerste onderzoeken en
noemde de chemische actie van enzymen katalytisch.
Berzelius: The concept of catalysis:
"The catalytic force is reflected in the capacity that
some substances have, by their mere presence and not by
their own reactivity, to promote changes in otherwise stable
and unreactive molecules...
... in living plants and animals, thousands of
catalytic processes occur within the tissues and
fluids,
generating a multitude of substances of differing chemical
compositions..."

Jons Jakob Berzelius
(1779Ė1848)
-
Bij zijn onderzoek naar verteringsprocessen isoleerde Theodor
Schwann in 1836 een substantie die verantwoordelijk was voor de
eiwithoudende vertering in de maag en noemde deze substantie
pepsine.
Pepsine ( Grieks: pepsis = verteren).
EC 3.4.23.1 officiŽle naam: Pepsin A
Alternatieve naam: Pepsin.

Theodor Schwann
( 1810 - 1882 )
-
De Duitse fysioloog
Wilhelm Friedrich KŁhne
(1837-1900) vond in 1867 een substantie in pancreassap die andere
biologische substanties afbrak.
Deze substantie noemde hij "Trypsine". ( Eng:
trypsin
EC 3.4.21.4)
KŁhne stelde voor de biokatalysatoren "enzymen" te
noemen. ( De naam "ferment" en "enzym"
zijn aan gist gerelateerd).

Wilhelm Friedrich KŁhne
-
In 1874 vervaardigde Hansen chymosine uit de magen van kalveren
voor de productie van kaas.
-
In 1883 ontwikkelde
Johan Kjeldahl een analytische methode
om stikstof te detecteren in bepaalde organische stoffen. Deze
methode was de basis voor de ontwikkeling van de kwantitatieve
enzymologie en algemene biotechnologie.

Johan Kjeldahl ( 1849 - 1900 )
-
In dit zelfde jaar (1883) ontdekte en ontwikkelde
Emil Christian Hansen een methode om gist te vermeerderen, waarna het mogelijk
werd gist te produceren voor industrieel gebruik.

Emil Christian Hansen ( 8 mei 1842 - 27
augustus 1909 )
-
Emil Hermann Fischer, die zijn onderzoek in suikers in 1883 begon, stelde de
moleculaire structuur van fructose, glucose en vele andere
suikers vast. Tijdens zijn stereochemisch onderzoek stelde hij
vast dat er twee soorten suiker zijn: D-suikers en
L-suikers. ( D = dextro =rechts en L= Levo = links).
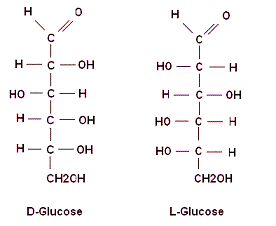
Hij onderzocht de reacties en de substanties die betrokken
zijn bij de fermentatie en legde tijdens zijn onderzoeken hoe
enzymen suikers afbreken de grondslag voor de enzymchemie.
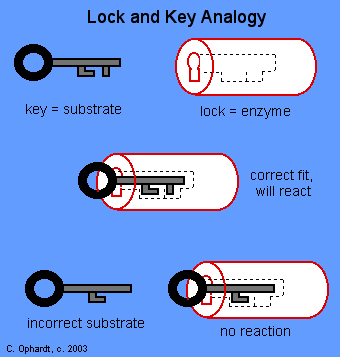
De specifieke actie van een enzym met een enkel substraat kan
worden uitgelegd volgens de "slot en sleutel"
theorie. Dit "slot en sleutel" verhaal werd voor het
eerst gepostuleerd door Fischer in 1895.
In dit verhaal is een enzym een slot en het substraat een
sleutel. Alleen de juiste sleutel (substraat) past in het
juiste slot (enzym).
( "... the intimate contact between the molecules
... is possible only with similar geometrical
configurations. To use a picture, I would say that
the enzyme and the substrate must fit together like a lock and key."
Emil Fischer, 1895 )

Emil Hermann Fischer
(1852-1919)
-
Later bleek dat het slot en sleutel verhaal niet geheel correct
is. Het is nu bekend dat de actieve zijde van enzymen
vormen hebben die corresponderen met vormen van het substraat
nadat het substraat gebonden is. Men heeft een aangepaste
theorie voorgesteld: "The induced fit" theorie.
Deze theorie neemt aan dat het substraat een rol speelt bij de
uiteindelijke vorm van het enzym en dat het enzym gedeeltelijk
flexibel is en werd in 1958 beschreven door
Daniel E. Koshland Jr

Daniel E. Koshland Jr. 30 maart 1920 - 23 juli 2007
-
Wilhelm Ostwald
definieerde in 1893 katalysatoren en enzymen en bevestigde de
katalytische theorieŽn van Jons Jakob Berzelius.

Wilhelm Ostwald (1853 - 1932 )
-
Jokichi Takamine was de eerste persoon die een enzym uit een
microbische bron vervaardigde. Hij vervaardigde
taka-diastase uit Aspergillus ( schimmelgeslacht) als een
verteringsenzym in 1894.

Dr. Jokichi Takamine:
Japanese Father of American Biotechnology
-
In 1926 werd het eerste enzym in pure vorm verkregen. Dit
feit werd volbracht door
James B. Sumner
van de
Cornell University. Sumner was in staat om het enzym
urease
uit een vrucht van de broodvruchtboom te isoleren en te
kristalliseren. Hiervoor kreeg hij in 1946 de Nobelprijs.
Sumner suggereerde, in tegenstelling tot de heersende
opvattingen, dat enzymen eiwitten zijn. De meeste critici in
die tijd geloofden dat pure enzymen geen eiwitten bevatten.
-
John H. Northrop
en
Wendell M. Stanley
van de
Rockefeller Institute for Medical Research
deelden de Nobelprijs met Sumner. Zij ontdekten een complexe
procedure om pepsine te isoleren.
Deze precipitatie techniek die bedacht is door Northrop
and Stanley werd gebruikt om verschillende enzymen te
kristalliseren.
Behalve pepsine, kristalliseerde Northrop ook
trypsine
en chymotrypsine; daarbij aantonend dat deze enzymen eiwitten
zijn.
|

|

|

|
|
James B. Sumner
|
John H. Northrop
|
Wendell M. Stanley
|
( Pepsine, een mengsel van eiwitsplitsende enzymen. Het
wordt in de maag gevormd uit het eiwit pepsinogeen. Het
breekt eiwitten af tot vrij grote peptidebrokstukken waarvan
verdere afbraak plaatsvindt in de dunne darm)
Pepsin A:
EC 3.4.23.1
; Pepsin B:
EC 3.4.23.2
; Pepsin C:
EC 3.4.23.3
Chymotrypsin:
EC 3.4.21.1; Chymotrypsin C:
EC 3.4.21.2
Link:
The Nobel Prize in Chemistry 1946
Enzymen:
Enzymen zijn producten van de levende cel.
Het unieke van een levende cel is, dat deze in staat is een grote
verscheidenheid aan reacties met grote efficiŽntie en
specificiteit ondanks de milde fysiologische omstandigheden (lage
temperatuur neutrale pH) te laten verlopen.
De belangrijkste stoffen die zorg dragen voor de processen in de
cel zijn de enzymen. De verbindingen die door de enzymen worden
omgezet noemt men substraten.
Enzymen zijn eiwitten die door het lichaam zelf worden aangemaakt
uit deeltjes van eiwit afkomstig uit de voeding. Meestal is een
enzym een zogenaamd samengesteld eiwit, dat wil zeggen een eiwit
chemisch verbonden met een niet-eiwit, dat als coŽnzym of als
activator kan optreden.
Een enzym is een splitsings - of ontledingsstof, die een bepaald
scheikundig proces in het organisme veroorzaakt of bevordert,
zonder zelf te veranderen. Enzymen zijn biochemische katalysatoren
zonder welke een stofwisseling en spijsvertering onmogelijk zouden
zijn.
Enzymen zijn zeer specifiek. Dat wil zeggen dat voor ieder
substraat een apart enzym nodig is. Voor de werking zijn enzymen
o.a. afhankelijk van de temperatuur en de zuurgraad. De meeste
enzymen katalyseren processen met een snelheid van 1 tot 10.000
omzettingen per seconde per enzymmolecuul.
De snelheid van de enzymatische reactie neemt toe naarmate de
hoeveelheid actief enzym groter is. Door een nauwgezette regulatie
van de actieve hoeveelheid van elk enzym is de levende cel in
staat het verloop van elke reactie te reguleren en hierdoor wordt
een strakke coŲrdinatie van alle chemische reacties mogelijk.
Aangezien vrijwel alle biologische processen (synthese, groei,
uitscheiding e.d.) door enzymen gekatalyseerd worden, worden de
fysiologische eigenschappen of het karakter van een levend
organisme (van een levende cel) bepaald door de enzymen die erin
aanwezig zijn. Dat een levercel zich blijft gedragen als een
levercel en nooit als een niercel (hoewel beide zijn ontstaan uit
ťťn enkele eicel) vloeit dus voort uit het feit dat een levercel
een bepaalde verzameling enzymen bezit en een niercel een andere
verzameling enzymen. Dat een bepaalde cel bepaalde enzymen wel en
andere niet bezit, komt doordat die cel alleen die bepaalde
enzymen kan produceren.
Enzymen en coŽnzymen hebben slechts een beperkte levensduur en ze
moeten op tijd vervangen worden. Daarom moeten er in het dieet
voldoende aminozuren, vitaminen en metaalionen aanwezig zijn om de
afgebroken enzymen en coŽnzymen tijdig te kunnen vervangen.
Vitaminen
zijn organische moleculen die onmisbaar zijn voor de opbouw van
enzymen en coŽnzymen die niet door het organisme zelf gemaakt
kunnen worden. Daardoor is het noodzakelijk dat ze via het voedsel
worden opgenomen.
De mens heeft eveneens slechts een beperkte mogelijkheid om
essentiŽle metaalionen op te slaan, en de biologische labiliteit
van de meeste metallo-enzymen vereist dat ook deze ionen dagelijks
via ons voedsel worden opgenomen.
Werking:
Voor de werking van de enzymen is het interne milieu van de
levende cel niet vereist. Ze kunnen dus na verbreking van de
celstructuur worden geÔsoleerd en gezuiverd en in de reageerbuis
(in vitro) worden bestudeerd. Hieruit blijkt dat de katalytische
eigenschappen van de enzymen verankerd zijn in hun structuur.
Het is gebleken dat het overgrote deel van de enzymen behoort
tot de eiwitten. Dankzij de sterk toegenomen kennis van de
eiwitstructuur is het mogelijk geworden de uitzonderlijke
eigenschappen van de enzymen te verklaren en te voorspellen. Een
eiwit blijkt te zijn opgebouwd uit een groot aantal
verschillende bouwstenen (aminozuren), die in een vaste,
specifieke volgorde aaneengeregen zijn. De specifieke volgorde
van de aminozuren in de eiwitketen is bepalend voor de wijze
waarop de ketens bij gegeven pH e.d. ruimtelijk worden
opgevouwen. Uitsluitend aan de aldus voorgeschreven ruimtelijke
structuur danken de enzymen hun specifieke eigenschappen.
Verlies van deze ruimtelijke structuur (denaturatie) leidt dan
ook tot activiteitsverlies.
Een enzym gaat met de om te zetten verbinding (het substraat)
een complex aan, dat na afloop van de reactie weer uiteenvalt in
product en onveranderd enzym. De binding van het substraat vindt
plaats aan ťťn bepaalde plek op het ruimtelijk eiwitbouwsel, het
actieve centrum. De rangschikking van de aminozuren in en rondom
dit actieve centrum is verantwoordelijk voor het katalytisch
effect en de goede rangschikking van de bij de activiteit
betrokken aminozuren is alleen bij de ene, unieke ruimtelijke
eiwitstructuur gerealiseerd.
De ruimtelijke
opvouwing van een
eiwitketen is onder meer afhankelijk van de pH (zuurgraad) en
dit verklaart de sterke pH-afhankelijkheid van de enzymatische
activiteit. De meeste enzymen zijn slechts in een zeer beperkt
pH-gebied optimaal actief (het optimum ligt doorgaans bij pH
5Ė8). Buiten dit pH-gebied verliezen de enzymen, soms op
irreversibele wijze, hun activiteit.
De effecten van een verandering in temperatuur kunnen worden
verklaard op basis van de kinetische theorie: een toename in
temperatuur doet de moleculen sneller bewegen waarbij er dus
meer botsingen plaatsvinden tussen de moleculen. Dit houdt in
dat binnen een bepaalde grens ( vaak 0 - 45 C ) de snelheid van
de reactie proportioneel is aan de temperatuur. Bij temperaturen
boven normaal ( zeg 60 C ) zullen enzymen denatureren; dat
wil zeggen dat onder invloed van de hoge snelheid de vorm en
ruimtelijke opvouwing zullen veranderen waardoor het enzym zijn
werking verliest.
Bij steeds lager wordende temperaturen zullen de moleculen
steeds minder snel bewegen en dus minder actief worden.
In vele gevallen kan de katalytische werking van de enzymen
worden verhoogd door bepaalde stoffen, die activatoren worden
genoemd. Voorbeelden hiervan zijn thiolverbindingen (zoals
mercapto-ethanol en cysteÔne), maar ook tweewaardige metaalionen
(Mg2+, Mn2+, Zn 2+ e.d.). Daarnaast zijn er stoffen die de
activiteit van de enzymen al of niet reversibel verlagen
(inhibitoren of remmers).
Allostere enzymen zijn enzymen waarvan de katalytische
activiteit specifiek beÔnvloedbaar is door bepaalde
metabolieten. Deze laatste binden op een andere plaats dan het
om te zetten molecuul van het enzym. Zij veranderen de structuur
van het enzym zodanig dat de activiteit ůf geremd, ůf
gestimuleerd wordt; deze invloed op de enzymactiviteit noemt men
een allosterisch effect. Zo kunnen stofwisselingprocessen
gereguleerd worden. Heel vaak wordt de activiteit van het eerste
enzym uit een reactieketen allosterisch geremd door het
eindproduct van de reactieketen (negatieve terugkoppeling). Zo
stapelt het eindproduct zich niet op (zie ook, Pasteureffect).
Met de ontdekking van de allosterische remming van enzymen
(1963) zijn de namen van de Franse Nobelprijswinnaars Changeux,
Jacques Monod
en
FranÁois Jacob
onlosmakelijk verbonden.
Er bestaan ook enzymen die in meer dan ťťn structurele vorm
voorkomen in ťťn en hetzelfde (hogere) organisme en toch
dezelfde reactie katalyseren, zogeheten iso-enzymen. Een goed
onderzocht voorbeeld is dat van melkzuurdehydrogenase, waarvan
in totaal vijf verschillende vormen (iso-enzymen) voorkomen. Er
zijn kleine enzymatische verschillen tussen de vormen die in de
hartspier, de lever en de longen voorkomen; deze vormen
beantwoorden echter aan de zeer verschillende fysiologische
eisen die aan deze drie organen worden gesteld.
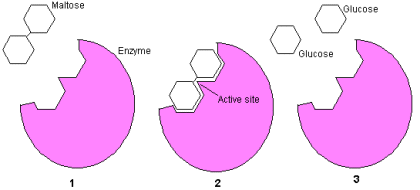
Maltose bestaat uit twee aan elkaar gebonden glucose
moleculen (1).
Het enzym Maltase ( Alpha-glucosidase
) is een proteÔne die precies zo gevormd is dat het
een maltose molecuul kan accepteren en de binding
kan verbreken.(2).
Twee glucose moleculen blijven over (3).
Een enkel maltase enzym kan tot 1000 maltose bindingen per
seconde verbreken en accepteert alleen maltose moleculen.
Alpha-glucosidase (
EC 3.2.1.20
)
Human genetic disease: Glycogen storage disease II (GSD II) (
Ziekte van Pompe )
OMIM:
232300
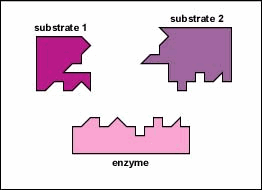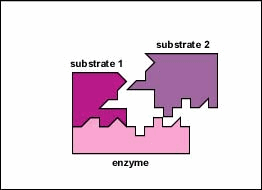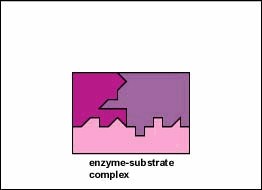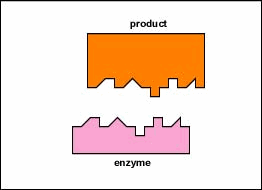
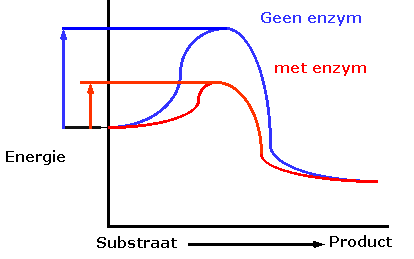
In de meeste chemische reacties bestaat een energiebarriŤre die
overwonnen moet worden voordat de reactie plaats kan vinden.
Deze barriŤre voorkomt dat complexe moleculen zoals proteÔnen en
nucleÔnezuren spontaan afgebroken worden en is dus nodig voor
het in stand houden van het leven.
Wanneer er echter in de cel bepaalde metabole veranderingen
vereist zijn, zullen bepaalde van deze complexe moleculen
afgebroken moeten worden en zal de energiebarriŤre overwonnen
moeten worden.
Warmte zou de extra benodigde energie kunnen leveren (
activatie-energie genoemd ), maar de toename in temperatuur zou
de cel vernietigen. Het alternatief is de verlaging van de
activatie-energie spiegel door het gebruik van een katalysator.
Dit is dan ook de rol die enzymen spelen. Zij reageren met het
substraat waarbij een overgangscomplex wordt gevormd die minder
energie vereist om de reactie te laten verlopen. Het onstabiele
tussenproduct zal snel worden afgebroken tot de reactieproducten
en het onveranderde enzym is vrij te reageren met andere
substraat moleculen.
Alleen een bepaald gebied van het enzym, de actieve zijde
genoemd, zal aan het substraat binden. Deze actieve zijde is een
gleuf of holte die gevormd wordt door het driedimensionale
vouwpatroon van de proteÔne. Deze driedimensionale structuur,
tezamen met de chemische en elektrische eigenschappen van de
aminozuren in de actieve zijde, staan alleen bepaalde substraten
toe te binden aan deze zijde, aldus de specificiteit van het
enzym bepalend.
De synthese en de activiteit van enzymen kan worden
beÔnvloed door genetische controle en de verdeling in de cel.
Sommige enzymen worden niet geproduceerd door bepaalde cellen en
andere worden alleen gevormd wanneer zij nodig zijn. Enzymen
worden niet altijd uniform in een cel gevonden; vaak worden zij
verdeeld in de nucleus, op het celmembraan of in subcellulaire
structuren. De snelheid van de enzym synthese en de activiteit
wordt verder beÔnvloed door hormonen, neurosecreties en andere
chemische stoffen die het interne milieu van de cel beÔnvloeden.
Omdat enzymen niet verbruikt worden in de reacties die
zij katalyseren en steeds weer opnieuw gebruikt kunnen worden,
is alleen een zeer kleine hoeveelheid van een enzym nodig om een
reactie te katalyseren. Een typisch enzymmolecuul kan 1000
substraat moleculen per seconde omzetten. De snelheid van de
enzymatische reactie neemt toe met een toenemende substraat
concentratie, waarbij de maximale snelheid wordt bereikt wanneer
alle actieve zijden van de enzymmoleculen zijn bezet. Het enzym
is dan verzadigd waarbij de snelheid van de reactie wordt
bepaald door de snelheid waarmee de actieve zijde het substraat
in product kan omzetten.
De activiteit van enzymen kan op verschillende manieren
geremd worden. Competitieve remming vindt plaats wanneer
moleculen die veel op de substraatmoleculen lijken, zich aan de
actieve zijde binden en zo voorkomen dat het eigenlijke
substraat zich aan de actieve zijde bindt. Penicilline is een
competitieve remmer die de actieve zijde van een enzym blokkeert
die vele bacteriŽn gebruiken om hun celwand op te
bouwen.
Niet competitieve remming vindt plaats wanneer een remmer
zich aan een enzym bindt op een locatie anders dan de actieve
zijde. In sommige gevallen van niet-competitieve remming denkt
men dat de inhibitor zich op zoín wijze aan het enzym bindt dat
de normale actieve zijde geblokkeerd wordt. In andere gevallen
denkt men dat de binding van de inhibitor de driedimensionale
vorm van het enzym verandert en zo de actieve zijde
vervormt waardoor er geen reactie met het substraat kan
plaatsvinden. De laatste vorm wordt allosterische remming
genoemd; de plaats waar de inhibitor aan het enzym bindt, wordt
de allosterische zijde genoemd. Vaak zal het eindproduct van een
metabole route dienen als een allosterische inhibitor op een
eerder enzym in de route. De remming van een enzym door een
product van zijn eigen metabole route is een vorm negatieve
feedback.
Allosterische controle kan zowel betrekking hebben op de
stimulatie van de enzym actie als ook de remming. Een
activatormolecuul kan aan de allosterische zijde gebonden worden
en een reactie uitlokken aan de actieve zijde door de
driedimensionale vorm van de actieve zijde te veranderen waarna
er een substraat past die deze vormverandering zelf niet kan
uitvoeren. Dit is de basis van de zogenoemde ďinduced fitĒ theorie die
stelt dat de binding van een substraat of sommige andere
moleculen aan een enzym een verandering in de
driedimensionale vorm veroorzaakt waarbij de activiteit
verbeterd of geremd wordt.
Algemene activators omvatten hormonen en de producten van
eerdere enzymatische reacties. Allosterische stimulatie en
remming staan de productie van energie en materialen door de cel
toe wanneer zij nodig zijn en remmen de productie wanneer de
toevoer voldoende is.
Regulatie:
Inleiding
regulatie [biochemie], het geheel van factoren (mechanismen)
dat regelend werkt op de hoeveelheid van een enzym in een cel en
zijn activiteit. In iedere cel komt een groot aantal verschillende
enzymen voor, die de opbouw- en afbraakprocessen van de
celstofwisseling verzorgen. Voor het optimaal functioneren van een
cel is het van belang dat onder alle omstandigheden slechts dŪe
enzymen werkzaam zijn en in zulke mate, als met dit optimaal
functioneren overeenstemt. Een algemeen regelend principe is de
terugkoppeling (feedback).
Regulatie van de aanmaak van enzymen
In de erfelijke aanleg van een cel (met name in het
DNA) ligt de informatie opgesloten voor de vorming van zeer veel
enzymen. Vrijwel nooit wordt deze aanleg in zijn geheel - en zeker
niet gelijktijdig - gerealiseerd. De voornaamste mechanismen die
in de regulatie van de enzymsynthese een rol spelen, zijn de
inductie en de repressie (een voorbeeld van terugkoppeling) van
enzymen (dit mechanisme geldt niet voor zogenaamde constitutieve
enzymen). Men spreekt in dit geval van een negatieve controle van
de gen-activiteit.
Daarnaast zijn er mechanismen waarbij de binding
van de RNA-polymerasen aan het genoom wordt beÔnvloed en zodoende
zowel de specifieke opstarting als de stopzetting van het
transcriptieproces wordt geregeld (positieve controle). Vooral bij
hogere organismen komen ook mechanismen voor die de translatie van
de gevormde boodschapper-RNA regelen.
Regulatie van de enzymactiviteit
Op de beÔnvloeding van de feitelijke
activiteit van een gegeven hoeveelheid van een bepaald
enzym oefenen de volgende factoren invloed uit:
Compartimentalisatie
In de cel komen bepaalde organellen voor
(zoals celkern, mitochondriŽn) die een verschillende uitrusting
aan enzymen bezitten. Een enzym in de kern kan uiteraard alleen
maar actief zijn als ook zijn substraat daar voorkomt. Voorbeelden
van de regulatie door compartimentalisatie zijn het pasteureffect
en de werking van lysosomen.
Intrinsieke eigenschappen
Een enzym kan actiever zijn naar gelang zijn
eigenschappen zoals zijn pH-optimum of zijn substraataffiniteit.
Wat dit laatste betreft: als verschillende enzymen eenzelfde
substraat kunnen omzetten (ieder op zijn eigen wijze), dan zal bij
een lage concentratie aan substraat alleen het enzym met een grote
affiniteit tot dit substraat nog actief kunnen zijn. Pas bij
hogere substraatconcentraties zullen ook de andere enzymen met het
substraat in interactie kunnen treden.
De aanwezigheid van activerende of remmende substanties
Belangrijk is de eindproductremming: bij de
synthese van vele stoffen katalyseert een aantal enzymen een
aantal opeenvolgende reacties; vaak is het eindproduct een remstof
voor een enzym dat vůůr in de keten werkt. Ook dit is een
voorbeeld van terugkoppeling. Dit mechanisme, waarbij normale
stofwisselingsproducten (metabolieten) als remstoffen of als
activatoren optreden, heeft geleid tot het herkennen van de
allosterische effecten. Vele enzymen zijn in hun activiteit
te reguleren doordat hun conformatie verandert in aanwezigheid van
bepaalde metabolieten. Daardoor verandert zowel hun affiniteit
voor het substraat als hun activiteit.
Scheiding tussen opbouw en afbraak
Doorgaans vindt in de stofwisseling de afbraak van
een stof plaats langs een andere weg dan haar opbouw. De synthese
van eiwitten bijv. loopt via een zeer complex systeem waarbij
allerlei typen RNA betrokken zijn, terwijl de afbraak hydrolytisch
(door kathepsinen) plaatsvindt. Er is dus geen eenvoudig evenwicht
tussen aminozuren en eiwit, maar de opbouw en de afbraak kunnen
afzonderlijk geregeld worden en naast elkaar, onderling
onafhankelijk, verlopen.
Enzymstructuur:
De molecuulmassa en de structuur van enzymen kan zeer variŽren.
Ribonuclease, een enzym dat nucleÔnezuren hydrolyseert die een
ribose-ring bevatten, is bijvoorbeeld een relatief klein eiwit met
een molecuulmassa van 13 700 u. Het bestaat uit 1 enkele
polypeptideketen van 124 aminozuureenheden.
In tegenstelling hiermee staat de ingewikkelde structuur van het
enzym aldolase dat betrokken is bij het glucosemetabolisme.
Dit enzym heeft een molecuulmassa van 156 000 u en bestaat uit
vier subeenheden met elk een molecuulmassa van ongeveer 40 000
u.
De polypeptideketens van leveraldolase hebben daarbij ook nog een
andere primaire structuur dan de polypeptiden van dit enzym in de
spieren.
Het macromoleculaire complex van pyruvaatdehydrogenase is zelfs
nog groter. Dit enzym katalyseert de belangrijke omzetting van
pyruvaat naar acetylcoŽnzym A.
Pyruvaatdehydrogenase is een multi-enzymcomplex waarbinnen de
verschillende componenten zo sterk aan elkaar verbonden zijn dat
het systeem als geheel geÔsoleerd kan worden uit verschillende
weefsels.
Het complex dat uit varkenshart geÔsoleerd wordt, heeft een
molecuulmassa van ongeveer 10 000 000 u en bevat 42 verschillende
polypeptiden en co-factoren, die allen nodig zijn voor de
biologische activiteit.
Enzymcofactoren:
Naast het polypeptidegedeelte hebben veel enzymen nog een
niet-proteÔnecomponent nodig om hun werking te kunnen uitoefenen.
Deze component wordt een cofactor genoemd. Wanneer een
cofactor nodig is, wordt het eiwitgedeelte het apoŽnzym genoemd.
De cofactor kan een metaalion zijn dat complex aan het enzym
gebonden is. Deze wordt dan de metaalionactivator genoemd.
Enkele voorbeelden van enzymen die een metaal-ion nodig hebben:
|
Metaal
|
Enzym |
| Na |
sucrose
α-D-glucohydrolase
|
| K |
pyruvate kinase ( vereist tevens Mg) |
| Mg |
Kinases ( bijv. hexokinase, pyruvate kinase);
adenosinetriphosphatases ( bijv. myosin
adenosinetriphosphatase)
|
| Fe |
Catalase, peroxidase, nitrogenase |
| Zn |
alcohol dehydrogenase, carboxypeptidase, carbonic anhydrase
|
| Mo |
Xanthine oxidase, nitrogenase |
| Cu |
cytochrome c oxidase, amine oxidase |
| Ni |
urease, hydrogenase, superoxide dismutase |
| Mn |
histidine ammonia lyase |
| V |
nitrogenase |
Veel enzymen hebben een organisch reagens nodig om de omzetting
van substraat naar product tot stand te brengen. Dit kan een
verbinding zijn die bijvoorbeeld een hydride-ion, een methylgroep,
of een acetylgroep overdraagt naar het substraat. Dergelijke
organische verbindingen die in vergelijking met het enzym relatief
klein zijn , worden
coŽnzymen genoemd. Er zijn coŽnzymen voor oxidatie, reductie,
alkylering, acylering, isomerisatie, decarboxylering enz.
Oxidatie is het proces waarbij elektronen worden afgestaan.
Reductie is het proces waarbij elektronen worden opgenomen.
Acylering is het proces waarbij aan een molecuul een vetzuur wordt
gekoppeld.
Isomerisatie is het ontstaan van stoffen met dezelfde
molekuulformule, maar met verschillende structuurformules.
Decarboxylering is het proces waarbij uit een verbinding de
carboxylaatgroep verwijderd wordt.
Alkylering is het proces waarbij aan een organische verbinding een
alkyl groep wordt toegevoegd.
Een coŽnzym zelf is niet specifiek voor een bepaald substraat. Het
is de combinatie enzym-coŽnzym die de specificiteit bepaald.
Als een cofactor stevig aan het enzym gebonden zit door middel van
covalente of coŲrdinatieverbindingen, dan wordt de cofactor een
prosthetische groep genoemd.
Sommige coŽnzymen zitten stevig gebonden aan het enzym als
prosthetische groep, andere komen vrij voor en kunnen door
verschillende enzymen gebruikt worden.
De heemgroep is een bekend voorbeeld van een prosthetische groep
en is onder meer gebonden aan de cytochromen en aan hemoglobine.
Nomenclatuur en indeling van enzymen:
Enzymen worden meestal benoemd naar het proces dat zij
katalyseren, gevolgd door de uitgang Ėase.
Men kan de enzymen op grond van hun werking indelen in zes
hoofdgroepen:
-
Oxidoreductasen
-
Transferasen
-
Hydrolasen
-
Lyasen
-
Isomerasen
-
Ligasen
Oxidoreductasen:
Deze enzymen katalyseren redoxprocessen.
Redoxprocessen zijn processen waarbij door
elektronenoverdracht ťťn van de atoomsoorten wordt geoxideerd en
een ander gereduceerd.
Oxidatie is het proces waarbij
elektronen worden afgestaan en reductie is het proces waarbij
elektronen worden opgenomen.
Tot de groep
oxidoreductasen behoren de hydrogenasen, oxidasenreductasen,
transhydrogenasen en hydroxylasen.
CoŽnzymen die bij
deze groep enzymen veel voorkomen zijn NAD+ en FAD.
Transferasen:
Deze enzymen katalyseren groepsoverdrachtsreacties zoals
methyl-, carboxyl-, acyl-, amino- of
fosfaatgroepsoverdracht.
Tot deze groep behoren onder
meer de transfosfatasen ( kinasen ) en de transaminasen.
Een coŽnzym dat bij de laatst genoemde een rol speelt is
pyridoxaalfosfaat.
Hydrolasen:
Deze enzymen katalyseren hydrolysereacties.
Hydrolyse
is een splitsing van scheikundige verbindingen onder opneming van
water.
Tot deze groep behoren de peptidasen,
esterasen, glycosidasen en de fosfatasen.
Een coŽnzym is niet nodig omdat water het reagens is.
Lyasen:
Deze enzymen katalyseren de splitsing van
koolstof-koolstof ( C-C ), koolstof-zuurstof ( C-O ) en
koolstof-stikstof ( C-N ) bindingen door middel van
eliminatiereacties.
Tot deze groep behoren de
decarboxylasen en de dehydratasen.
CoŽnzymen die
behulpzaam zijn bij deze categorie enzymen zijn onder meer CoŽnzym
A en thiaminepyrofosfaat.
Isomerasen:
Deze enzymen katalyseren isomerisatiereacties.
Isomeren
zijn stoffen met dezelfde molekuulformule, maar met verschillende
structuurformules.
Tot deze groep behoren de racemasen
en de epimerasen.
-
Fosfohexose-isomerase
(Glucose-6-phosphate
isomerase)
EC 5.3.1.9 dat in de glycolyse de omzetting van glucose-6-fosfaat in
fructose-6-fosfaat katalyseert, is een voorbeeld uit deze
groep.
Dit enzym katalyseert de reactie:
D-glucose 6-phosphate <=> D-fructose 6-phosphate
Human genetic disease:
Glucose-6-phosphate isomerase deficiency
OMIM:
Hemolytic anemia due to phosphoglucose isomerase
deficiency
Ligasen :
deze enzymen katalyseren de koppeling van twee
substraten waarbij een binding van een koolstofatoom met een
zuurstof-, stikstof-, zwavel- of een ander atoom gevormd wordt.
De
energie die voor de bindingsvorming nodig is wordt meestal
geleverd door hydrolyse van ATP.
Tot deze groep behoren de synthetasen en de carboxylasen.
CoŽnzymen die bij deze categorie enzymen voorkomen
zijn coŽnzym A en biotine.
Binnen deze hoofdgroepen vindt naar soort substraat of
reactietype nog een verdere onderverdeling plaats in subgroepen en
sub-subgroepen, waarbinnen de afzonderlijke enzymen genummerd
worden.
Elke groep heeft een eigen codecijfer waardoor
men de enzymen kan indelen door middel van een vierdelig
codenummer. ( het enzym classificatienummer of EC nummer).
Elk volgend cijfer van het nummer geeft dus een meer
gedetailleerde onderverdeling en op deze wijze is naast de
triviale naam en de systematische naam nog een derde aanduiding
voor een enzym mogelijk.
De systematische naam van
bijvoorbeeld lactaatdehydrogenase ( triviale naam ) is
L-lactaat-NAD-oxidoreductase en het codenummer is EC 1.1.1.27.
( EC 1.1.1.27 )
Restrictie enzymen
Restrictie enzym of ook wel Restrictie endonuclease:
De term restrictie vindt zijn oorsprong in het feit dat
deze enzymen werden ontdekt in E. coli strengen die de infectie
van zekere bacteriofagen bleken te beperken.
"Endo" in endonuclease betekent dat een
enzym binnen in een DNA-streng knipt; Grieks: endo = in -
binnenin.)
Nuclease: enzymen die de hydrolyse katalyseren van phosphodiester
bindingen tussen nucleÔne zuren in DNA
moleculen.
Een restrictie-enzym of ook wel restrictie endonuclease
genoemd, is een proteÔne die geproduceerd wordt
door bacteriŽn. Deze proteÔnen zijn in staat DNA-moleculen
op een specifieke manier in kleinere fragmenten te
splitsen. Een bijzondere eigenschap van
deze enzymen is bovendien dat ze een bepaalde (voor elk enzym
kenmerkende) specifieke basenparen-volgorde (ook wel sequentie
genoemd) (minimaal 4 basenparen)
in het DNA herkennen en alleen op deze specifieke plek in het DNA
de fosfodiŽsterbindingen tussen de nucleotiden hydrolyseren. (het
"knippen").
Er bestaan verschillende typen restrictie enzymen en die kunnen
allemaal een andere volgorde herkennen. Sommige enzymen knippen
beide DNA-strengen door op dezelfde plaats (blunt end); anderen
knippen de strengen schuin door, op enkele basen van elkaar
verwijderd (sticky end).
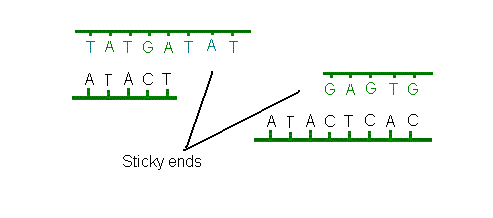
Met behulp van andere enzymen, de ligasen, kunnen de verschillende
fragmenten weer aan elkaar worden gelijmd. Het enzym EcoRl
herkent bijvoorbeeld zes basenparen (GAATTC), terwijl het enzym
Sau3AI slechts vier basenparen (GATC) herkent. De eerste
wordt daarom een '6-knipper' genoemd, terwijl de tweede een
'4-knipper' wordt genoemd
Een bacterie gebruikt
restrictie-enzymen als een afweermechanisme tegen
soortvreemd DNA, zoals bijv. het DNA van een bacteriofaag
(een type virus dat specifiek bacteriŽn aantast ) die de cel infecteert. Wanneer een faag een bacterie
infecteert, zal de faag zijn DNA in de bacteriŽle cel plaatsen
zodat dit DNA zich kan vermeerderen. Een restrictie endonuclease
voorkomt de vermeerdering van het DNA van de faag door het DNA
van de faag in vele stukken te knippen. Het eigen DNA van de cel
wordt tegen afbraak beschermd door enzymatische modificatie
(methylering) van de specifieke herkenningsplaatsen van het
restrictie-enzym. Een klein gedeelte van het bacteriofaag DNA
ontsnapt eveneens aan restrictie doordat het ook specifiek
gemethyleerd wordt. Een faag dat een dergelijk gemodificeerd DNA
bevat, vermenigvuldigt zich, bij een tweede infectie van
dezelfde gastheer, veel beter dan het oorspronkelijke faag met
ongemodificeerd DNA.
Er zijn veel bacteriestam specifieke
restrictie-enzymen. Alleen bacteriofagen, die uit dezelfde
bacteriestammen komen hebben de mogelijkheid de methylering te
omzeilen en kunnen zich zo in de bacterie vermeerderen. De
vermeerdering is dus beperkt tot deze stammen, vandaar de naam
restrictie-enzym.
Voor hun grondleggend onderzoek naar restrictie-enzymen en hun
toepassing in de moleculaire biologie kregen
Werner Arber,
Daniel Nathans
en
Hamilton Othanel Smith
in 1978 de
Nobelprijs voor de Fysiologie of Geneeskunde.
Overzicht restrictie endonucleasen:
New England BioLabs.
Typen:
Er zijn drie typen restrictie-enzymen, type I, II en III
genoemd.
Type I enzymen zijn complexe, multisubunit, combinatie
restrictie- en Ėmodificerings enzymen die het DNA op een
willekeurige plaats ver van de herkenningsplaats knippen.
Type II knipt het DNA op bepaalde plaatsen dicht bij of binnen
de herkenningsplaats.
Type III enzymen zijn net als type I enzymen grote
enzymcomplexen die het DNA ongeveer 20 tot 25 baseparen van de
herkenningsplaats verwijderd knippen.
Type I en III enzymen zijn gelijk in de zin dat zowel de
restrictie als de methylase activiteit worden uitgevoerd door een
groot enzymcomplex, dit in tegenstelling tot type II waarbij de
restrictie enzym onafhankelijk is van de methylase activiteit.
In het dagelijks leven wordt meestal met restrictie-enzym type II
bedoeld, omdat de andere twee typen van minder belang zijn in de
moleculaire biologie. De naam van een restrictie-enzym geeft de
herkomst aan. Het enzym EcoRI bijvoorbeeld is het
eerst gevonden enzym uit de stam Escherichia coli R en
AluI is het eerste enzym uit
Arthrobacter luteus. Restrictie-enzym, die opdezelfde
plaatsen knippen maar afkomstig zijn uit verschillende organismen
worden isoschizomeren genoemd; knippen ze in dezelfde
sequentie, maar zijn de knipeinden verschillend dan worden ze
neoschizomeren genoemd.
Toepassingen:
Nathans was de eerste die besefte dat type
II-restrictie-enzymen een zeer belangrijk gereedschap kon zijn
bij het onderzoek naar de organisatie van genen op het DNA.
Met deze enzymen, waarvan er inmiddels meer dan 3000 zijn
geÔsoleerd, met elk hun eigen herkenningsvolgorde, is het
mogelijk lange DNA-moleculen reproduceerbaar in precies
gedefinieerde fragmenten (restrictiefragmenten) te
knippen.
Men kan een restrictie-analyse uitvoeren door de fragmenten op
lengte te scheiden met behulp van elektroforese in agarose of
polyacrylamide.
De resultaten worden verwerkt tot een
restrictiekaart waarop de onderlinge ligging en afstand
van de knipplaatsen van de verschillende restrictie-enzymen
(restrictie-plaatsen) zijn aangegeven.
Een dergelijke restrictiekaart kan ook worden opgesteld voor de
restrictiefragmenten van ťťn individueel gen. Dit is een
belangrijk hulpmiddel bij het ophelderen van de fijnstructuur
(nucleotidenvolgorde) van het gen.
Daartoe worden de verschillende fragmenten van het gen, met
behulp van de recombinant DNA-techniek, afzonderlijk gekloneerd
en wordt hun nucleotidenvolgorde bepaald.
Het functioneren van het gen kan worden bestudeerd door
specifieke fragmenten te verwijderen, te vervangen door andere
of te muteren. Type II-restrictie-enzymen vormt dan ook een van
de pijlers waarop het hedendaagse DNA-onderzoek rust. Tussen
individuen van dezelfde soort bestaan soms kleine verschillen in
de restrictiekaart van een bepaald stuk DNA als gevolg van ťťn
of meer mutaties die restrictieplaatsen hebben vernietigd of
nieuwe plaatsen hebben gecreŽerd. Dit
restrictiefragment lengte polyformisme (RFLP) kan
onder meer worden gebruikt als hulpmiddel bij het geven van een
genetisch advies.
Is eenmaal vastgesteld dat in een familie een bepaald
restrictiepatroon gecorreleerd is met de aanwezigheid van een
(recessieve) mutatie die een erfelijke afwijking veroorzaakt,
dan kan middels restrictie-analyse worden bepaald of de
betreffende ouder mogelijk drager van deze mutatie is; ook
prenatale diagnose is langs deze weg mogelijk.
Indeling type II restrictie endonucleasen:
Het hoofdcriterium voor de indeling als een type II restrictie
enzym is:
Omdat vele type II enzymen niet aan deze beperkte definitie
voldoen is het nodig een aantal subindelingen te
definieren:
Voorbeelden van restrictie enzymen
|
Enzyme
|
Organism from which derived
|
Target sequence
(cut at *)
5' -->3'
|
| Ava I |
Anabaena variabilis |
C* C/T C G A/G G |
| Bam HI |
Bacillus amyloliquefaciens |
G* G A T C C |
| Bgl II |
Bacillus globigii |
A* G A T C T |
| Eco RI |
Escherichia coli RY 13 |
G* A A T T C |
| Eco RII |
Escherichia coli R245 |
* C C A/T G G |
| Hae III |
Haemophilus aegyptius |
G G * C C |
| Hha I |
Haemophilus haemolyticus |
G C G * C |
| Hind III |
Haemophilus inflenzae Rd |
A* A G C T T |
| Hpa I |
Haemophilus parainflenzae |
G T T * A A C |
| Kpn I |
Klebsiella pneumoniae |
G G T A C * C |
| Mbo I |
Moraxella bovis |
*G A T C |
| Mbo I |
Moraxella bovis |
*G A T C |
| Pst I |
Providencia stuartii |
C T G C A * G |
| Sma I |
Serratia marcescens |
C C C * G G G |
| SstI |
Streptomyces stanford |
G A G C T * C |
| Sal I |
Streptomyces albus G |
G * T C G A C |
| Taq I |
Thermophilus aquaticus |
T * C G A |
| Xma I |
Xanthamonas malvacearum |
C * C C G G G |
Note: Only one strand of the target DNA is shown, in the
interests of clarity. It will be noted that the omitted strand has
the same sequence as the one show, but the nucleotides occur in
the reverse order. Thus for example The complementary sequence for
Sal I (with its point of cleavage indicated as above) is 5' -C A G
C T * G-3'. These are hence said to be palindromic sequences, and
double-stranded cuts produce short sinlge-stranded cohesive ends.
LINK:
Structure and Function of Type II Restriction Endonucleases
(PDF)
Denatureren van eiwitten
Bij het denatureren van eiwitten worden de secundaire, tertiaire
en quaternaire structuur verbroken omdat de balans tussen alle
aantrekkende en afstotende krachten in een eiwitketen verstoord
wordt. Hierdoor verandert de driedimensionale vorm van het eiwit.
Sommige eiwitten zijn uit de aard van hun functie vrij goed
bestand tegen denaturering: bijvoorbeeld huid, haar en nagels
worden niet gemakkelijk gedenatureerd omdat ze veel
disulfidebruggen bevatten.
Veel enzymen daarentegen worden snel gedenatureerd wanneer hun
omgeving teveel gaat afwijken van de natuurlijke omstandigheden.
Door denaturering gaat de activiteit van het enzym verloren.
Denaturering kan op verschillende manieren gebeuren, bijvoorbeeld
door temperatuurverhoging of pH-verandering. Meestal coaguleren
(stollen) eiwitten bij het denatureren ( stremmen, uitvlokken).
Een bekend voorbeeld voorbeeld van denatureren door
temperatuurverhoging is het geleren van het eiwit (albumine) van
een ei tijdens het koken, het inactiveren van enzymen en het doden
van bacteriŽn door verhitten.
Ionen van zware metalen kunnen een eiwit denatureren omdat ze
binden aan thiol-groepen waardoor het eiwit neerslaat. Ook kunnen
ze complexen vormen met de carbonylgroepen in een eiwit
waardoor waterstofbruggen in het eiwit verbroken worden. Ook
bestraling, ultrasone vibratie, oxidatie, reductie (verbreken S -
S bruggen) en het toevoegen van detergentia of organische
oplosmiddelen kan denaturering veroorzaken. De desinfecterende
werking van een 70% ethanoloplossing berust op de snelle
denaturering van bacterie-eiwitten, waardoor de bacteriŽn gedood
worden.
Klinische enzymologie
|
Dr J. Kortleven
Enzymen en enzyme-eenheden
Enzymen zijn katalysatoren: zij katalyseren de omvorming
van een substantie (het substraat) in een andere (het
product).
De concentraties van enzymen in het serum zijn te klein om
bepaald te kunnen worden, en we moeten ons dan ook
tevreden stellen met het meten van de activiteit van het
enzyme, bepaald uit de snelheid van het verdwijnen van het
substraat of het verschijnen van het produkt. We meten dus
enzyme-activiteit. Enzyme-activiteit wordt
uitgedrukt in internationale eenheden (I.U. =
International Unit). 1 IU is de enzyme-activiteit waardoor
1 micromol substraat per minuut wordt omgezet.
De hoeveelheid omgezet substraat hangt af van de
temperatuur, de pH, het type en de concentratie van het
substraat. Normale waarden verschillen dan ook van labo
tot labo.
Er is een zekere tendens om alle gemeten grootheden uit te
drukken in SI-eenheden (SystŤme Internationale). Dan
worden er geen mU/ml meer gebruikt maar katal/liter.
Verhoogde enzyme-activiteit
Enzyme-activiteit is in het algemeen hoog in cellen, laag
in serum. Normale serum enzyme-activiteit is het gevolg
van een voortdurend "uitzweten" van enzymen uit
cellen en van een natuurlijke afbraak van cellen. (Enkele
enzymen komen vooral of uitsluitend in serum of plasma
voor (pseudocholinesterase, enzymen van de bloedstolling),
of worden door exocriene klieren uitgescheiden (amylase,
lipase)).
In de cellen komen de enzymen vrij voor, of gebonden aan
intracellulaire organellen (microsomen, mitochondriŽn). De
instandhouding van de cel vraagt een voortdurende metabole
inspanning. Wanneer een cel beschadigd wordt of aan
zuurstofgebrek lijdt breekt de celmembraan, en lekken
intracellulaire bestanddelen het serum in. Ernstige
letsels, die tot celdood leiden beschadigen ook de
mitochondriŽn, en veroorzaken een vrijkomen van de
mitochondriŽle enzymen.
Het stijgen van de serumenzymen kan ook voorkomen zonder
celbeschadiging: gestegen aanmaak in de cel zal ook een
stijging van het uitlekken uit de cel veroorzaken. Dit is
het geval bij alcoholgebruik, cholestase, sommige
anticonvulsiva. Hierbij ziet men de alkalische fosfatasen
en de gamma-glutamyltransferase stijgen, zowel in de
levercellen als in het serum.
Enzymen die vrijkomen in het bloed worden zeer vlug
geÔnactiveerd en opgenomen in het reticuloŽndotheliaal
stelsel.
|
Halfwaardetijd van enkele enzymen
|
| GOT |
17 Ī 5 uren |
| GPT |
47 Ī 10 uren |
| LDH1 (HBDH) |
113 Ī 60 uren |
| LDH5 |
10 Ī 2 uren |
| CPK |
Ī 15 uren |
| ALP |
3 tot 7 dagen |
| GGT |
3 tot 4 dagen |
| CHE |
Ī 10 uren |
| Amylase |
3 tot 6 uren |
| Lipase |
|
Staalname
Enzymen kunnen bepaald worden in serum, plasma, of andere
lichaamsvochten. De meeste anticoagulantia inhiberen in
meerdere of mindere mate sommige enzymen, en men verkiest
dan ook meestal de dosering uit te voeren op serum.
Enzymen zijn in hoge concentratie aanwezig in de cellen,
ook in de rode bloedcellen, en het is dus uiterst
belangrijk hemolyse te vermijden. Vooral LDH stijgt sterk
bij hemolyse.
Over het algemeen zijn enzymen stabiel in serum
(afgescheiden van RBC) gedurende 24 uur op
kamertemperatuur, vijf dagen in de koelkast, 2 tot 3
maanden in de diepvriezer.
Natuurlijk bestaan er uitzonderingen op deze regel: zure
fosfatasen verminderen zeer sterk tenzij men het serum
aanzuurt of in contact laat met de bloedklonter.
Stalen voor LDH-isoŽnzymen moeten op kamertemperatuur
bewaard worden: LDH5 wordt gedenatureerd bij koelkast of
diepvries temperatuur.
PatiŽnten-variabelen
-
leeftijd en geslacht: zijn belangrijk bij de
bepaling van alkalische fosfatasen: de waarden zijn
verhoogd zolang er actieve beenaanmaak gebeurt. Na de
leeftijd van 60 jaar stijgen de waarden, mťťr bij
vrouwen dan bij mannen.
-
inspanning: spierinspanningen, vooral bij
ongeoefende personen veroorzaken een stijging van LDH en
GOT en hebben een massieve stijging van CPK-waarden tot
gevolg. Zelfs lichte spieroefening of intramusculaire
inspuitingen lokken verhoogde CPK-waarden uit.
-
medicatie: anticonvulsiva en alcoholgebruik
verhogen de GGT en ALP-waarden. Ook andere waarden
kunnen interfereren. Er bestaan lijsten met mogelijke
interferenties.
-
voedselinname: in principe wordt bloed voor
enzyme-bepalingen nuchter afgenomen. Dit is niet steeds
mogelijk. Alkalische fosfatasen kunnen na voedselinname
verhoogd zijn bij sommige patiŽnten.
Enzyme-testen als hulpmiddel bij diagnose
De concentratie van enzymen in cellen is veel hoger dan in
serum, en het is dan ook begrijpelijk dat enzymtesten zeer
gevoelige indicatoren zijn voor celletsels. Men mag
rekenen dat enzymtesten een gevoeligheid hebben van mťťr
dan 90%: dit betekent dat er zeer weinig vals-negatieve
uitslagen zijn (een negatieve uitslag sluit ziekte
uit).
Enzymtesten missen echter specificiteit: abnormale
resultaten zijn dikwijls vals-positief, vooral als de
prevalentie van de ziekte laag is.
De specificiteit kan verhoogd worden door het bepalen van
isoŽnzymen: bij verschillende enzymen is de totale
activiteit de som van de activiteit van meerdere fracties,
die verschillen in fysico-chemische eigenschappen. Zeer
dikwijls is een bepaalde fractie orgaan-specifiek. Het
bepalen van de isoŽnzym-activiteit van LDH, CPK en ALP is
klinisch zinvol.
|
Relatieve concentratie van enzymen intra- en
extra-cellulair
|
| |
Serum
|
RBC
|
Lever
|
Hart
|
Spier
|
| ASAT (SGOT) |
1 |
x 15 |
x 7.000 |
x 8.000 |
x 5.000 |
| ALAT (SGPT) |
1 |
x 7 |
x 3.000 |
x 400 |
x 300 |
| LDH |
1 |
x 300 |
x 1.500 |
x 1.000 |
x 700 |
| CPK |
1 |
x 0,1 |
x 0,01 |
x10.000 |
x 50.000 |
Bespreking van enkele serumenzymen
-
Transaminasen (GOT of ASAT : glutamaat oxaalacetaat transaminase
of aspartaat aminotransferase en GPT of ALAT :
alanine amino-transferase of glutamaat
pyruvaattransferase).
GOT komt vooral voor in hart en lever, minder in de
gestreepte spieren, nieren en pancreas. Het bevindt zich
zowel in het cytoplasma als in de mitochondriŽn.
GPT komt vooral in de lever voor, minder in de nieren en
de skelet-spieren. Het bevindt zich vooral in het
cytoplasma.
De lever bevat ongeveer driemaal zoveel GOT als GPT. Bij
lichte leverbeschadiging zal vooral GPT vrijkomen en de
waarden van GPT liggen dan hoger dan die voor GOT. Bij
ernstige leverbeschadiging (met celnecrose) zal ook
mitochondriaal GOT vrijkomen, en zal de GOT-waarde de
GPT-waarde overtreffen. De verhouding tussen deze twee
enzymen (De Ritis quotiŽnt = GOT/GPT) is dus een maat voor
de ernst van de celbeschadiging.
Klinisch nut:
-
myocardinfarct: na myocardinfarct (6 tot 10 uur
na necrose) komen grote hoeveelheden GOT in het serum
vrij, met een maximum na 24 tot 48 uur. Indien er geen
leverlijden is duidt een nieuwe piek op bijkomende
necrose. Zware arythmieŽn en ernstige angina pectoris
kunnen evenwel ook GOT-stijging veroorzaken.
Ongecompliceerde hartdecompensatie of longinfarcten
veroorzaken weinig verandering van de GOT-spiegels. GPT
stijgt weinig of niet na infarct.
-
leverziekte: leverbeschadiging (infectieuze of
toxische hepatitis, congestie, galwegenobstructie,
actieve cirrose) veroorzaken een stijging van de GOT en
de GPT activiteit. Bij hepatitis treedt deze stijging
zeer vroeg op, gewoonlijk voor het verschijnen van de
icterus. De enzyme spiegels dalen ook weer vlug en
worden terug normaal nog voor totale genezing van de
parenchymletsels. De GPT daalt trager dan de GOT.
Obstructieve icterus, metastasen, chronische actieve
cirrose veroorzaken matige stijging. Ook pancreatitis en
mononucleosis infectiosa geven een matige stijging van
de transaminasen. Bij cholecystitis zonder icterus
blijven de transaminasen in principe normaal.
-
sommige spierziekten (progressieve musculaire
dystrofie) (ook dermatomyositis) geven een matige
stijging van de GOT, weinig of geen stijging van de GPT.
2
Lactaat dehydrogenase (LDH)
LDH komt voor in skeletspieren, lever, hart, nieren, rode
bloedcellen, hersenen, tumorcellen, atypische lymfocieten.
Het is dus een weinig specifiek enzyme. Zijn stijging kan
wijzen op een brede waaier van aandoeningen: hemolyse,
lever- of hartziekten, ook andere aandoeningen. Zijn
specificiteit wordt vergroot door het scheiden van de
isoŽnzymen:
LDH-isoenzymen
LDH heeft vijf
isoŽnzymen: genummerd van 1 tot 5 volgens de mobiliteit in een
elektrisch veld (elektroforese): de snelst bewegende
fractie is LDH1: LDH1 komt vooral voor in het hart en in
de rode bloedcellen (LDH1 = HBDH = Hydroxy boterzuur
dehydrogenase).
Het traagste isoŽnzyme is LDH5: LDH5 komt vooral voor in
de lever en de skeletspieren.
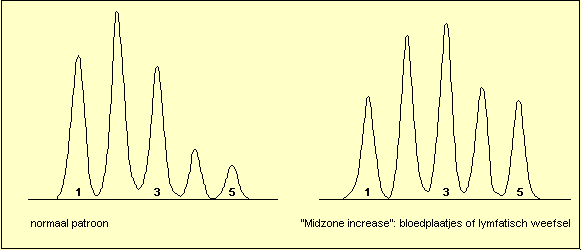
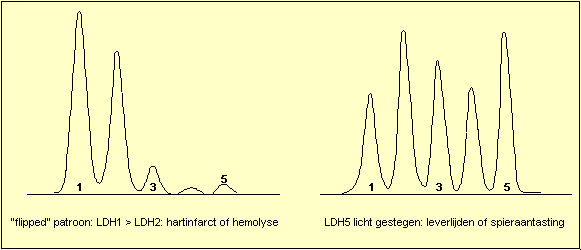
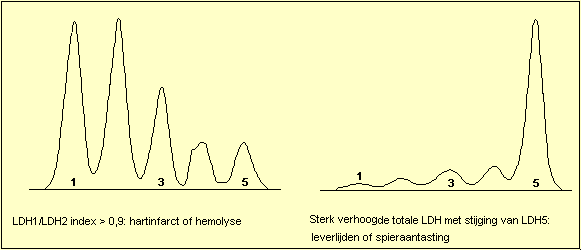
Wanneer de totale LDH-activiteit gestegen is kan men een
viertal patronen herkennen: stijging van LDH1, zodat LDH1
hoger wordt dan LDH2 ("flipped") is het hart en
hemolyse patroon. Stijging van LDH5 duidt op letsels van
de lever of van de skeletspieren. Stijging van LDH2, LDH3
en LDH4 ("Midzone increase") wordt voornamelijk
gezien bij aantasting van de bloedplaatjes of van het
lymfatisch systeem. Het niet specifieke patroon (isomorf
patroon) komt overeen met de normale verdeling en laat
geen specifieke diagnose toe.
Op volgende afbeeldingen worden enkele typische patronen
getoond. (voor het nut van LDH-isoŽnzymen bij hartinfarct:
zie ook "Laboratoriumdiagnose van Acuut Myocard Infarct")
Klinisch nut:
-
Hartziekten
LDH en LDH-isoŽnzymen worden
meestal gevraagd om de diagnose van hartinfarct te
kunnen stellen of te bevestigen.
LDH stijgt relatief langzaam: de stijging begint 24 tot
72 uur na het infarct, en de hoge waarden blijven 10 tot
14 dagen bestaan.
De verhouding van de verschillende isoŽnzymen verandert
vůůr de stijging van de totale LDH- activiteit begint:
men kan na 24 uur reeds een "flipped" patroon
opmerken, bij normale totale LDH. Dit omkeren van het
LDH-isoŽnzyme patroon is uiterst waardevol bij het
stellen van de differentiŽle diagnose tussen
myocardinfarct en angina pectoris.
Longziekten hebben geen invloed op de verhouding
LDH1/LDH2. Indien er bij hartziekte levercongestie
optreedt worden ook een aantal levercellen beschadigd en
zal ook LDH stijgen.
Ontstekingen van de hartspier verhogen ook LDH1:
myocarditis bijvoorbeeld produceert een
"flippend" isoŽnzyme patroon, maar de totale
LDH stijgt weinig. Ook hartoperaties veroorzaken een
tijdelijke (enkele dagen) omgekeerde LDH1/LDH2
verhouding.
-
Leverziekten:
LDH5 is het lever-isoŽnzyme.
Acute hepatitis veroorzaakt een enorme LDH-stijging die
volkomen voor rekening van LDH5 komt. Deze stijging
begint voor het verschijnen van de icterus. LDH5 daalt
vrij vlug, eerder dan bijvoorbeeld GPT.
Ook toxische hepatitis (na geneesmiddelen) veroorzaakt
een stijging van LDH5. Bij mononucleosis infectiosa
stijgt de totale LDH soms zeer hoog, LDH5 stijgt slechts
matig. Cholangitis en obstructieve icterus hebben
slechts weinig invloed op LDH.
Bij levermetastasen is de verhouding LDH4/LDH5 meestal
groter dan 1,05. Een verhouding LDH4/LDH5 kleiner dan
1,05 wijst eerder naar primair hepatoma (hepatocellulair
carcinoma).
-
bloedziekten:
Het is zeer moeilijk een
onderscheid te maken tussen de verschillende
hematologische aandoeningen aan de hand van
LDH-isoŽnzymen: in het algemeen is LDH1 afkomstig van de
rode bloedcellen, LDH2 van de granulocieten, LDH3, 4, 5,
van beschadigde lymfocieten. Lymfomen geven evenwel een
stijging van LDH2.
-
andere ziekten
Longweefsel
is rijk aan LDH3, en bij destructie van longweefsel zal
men dan ook een stijging van LDH3 zien. Interpretatie is
dikwijls echter moeilijk: bij longinfarct bijvoorbeeld
worden er ook een groot aantal rode bloedcellen
gehemolyseerd, met stijging van, naast LDH3, ook LDH1:
dan wordt de differentiŽle diagnose met hartinfarct
eerder moeilijk.
Skeletspieren bevatten vooral LDH5, met een
weinig LDH4 en LDH3. Na zware spierinspanning kan het
totale LDH stijgen, maar de verhouding LDH1/LDH2 blijft
gelijk.
3.
Creatinine kinase (CK of CPK : creatinine
phospho-kinase)
Creatine fosfokinase komt voor in de gestreepte spieren,
de hartspier, de darm en de hersenen. Na beschadiging van
een gestreepte spiercel komt het CK zeer snel vrij in het
serum, na hersenbeschadiging stijgt CK langzaam. Het
enzyme wordt zeer vlug uit het bloed verwijderd.
CK is waarschijnlijk een van de beste indicatoren van
hartinfarct: het stijgt zeer vlug en het komt zeer weinig
in andere weefsels voor.
Het feit dat minimale traumata van de skeletspieren ook CK
stijging kunnen veroorzaken maakt deze gevoelige indicator
echter weinig specifiek: spierarbeid, een val, een
intramusculaire injectie zijn voldoende om de CK-spiegels
omhoog te jagen.
CK heeft drie isoŽnzymen: MM, MB, BB. Ze kunnen met
verschillende technieken gescheiden worden. MM (M voor
muscle) komt voor in spier- en hartweefsel. BB (B voor
brain) komt voor in de hersenen. MB komt uitsluitend voor
in de hartspier.
In normaal serum vindt men MM en een spoortje MB. MB komt
in grote hoeveelheden in het serum na myocardinfarct. BB
wordt soms gevonden na acuut hersenletsel, maagcarcinoma,
prostaat carcinoma, en bij patiŽnten die chronische
dialyse of coronaire bypasschirurgie ondergaan.
Wij gebruiken voor het bepalen van
CK-MB een immunologische
techniek waarbij alle M-componenten geÔnactiveerd worden
(MM en het M-deel van MB). Daarna wordt de overblijvende
activiteit gemeten, die dus (meestal) een maat is voor de
activiteit van CK-MB.
Klinisch nut:
-
Spierziekten
acute en voortschrijdende
spiernecrose veroorzaakt een astronomische stijging van
CK: deze stijging is een gevolg van de beschadiging van
actieve spiervezels, en is dan ook het hoogst in het
begin van de ziekte. Naarmate de spiermassa vermindert,
vermindert ook de hoeveelheid circulerend CK en de
enzyme activiteit heeft weinig prognostische of
diagnostische waarde bij gevorderde spieraandoeningen.
CK-activiteit is hoger dan normaal bij de meeste
vrouwelijke carriers van musculaire dystrofie (Duchenne
- X-chromosoom gebonden), zonder evenwel diagnostisch te
zijn.
Ook polymyositis, dermatomyositis, zware hypothyreoÔdie
met spierafwijkingen geven verhoogde CK-waarden.
-
hartziekten
de aanwezigheid van CK-MB is de
meest gevoelige "marker" van myocardinfarct.
CK-MB verschijnt vroeg (binnen de 24 uur na een
infarct). Het stijgt niet na longembolen,
hartdecompensatie, angina pectoris (men heeft evenwel
ook stijging van CK-MB beschreven na spiertrauma,
langdurige tachy-arythmieŽn, zeer zware angina).
Het is waarschijnlijk niet mogelijk uit de stijging van
CK-MB conclusies te trekken betreffende de omvang van
het infarct: de stijging van de enzyme-activiteit in het
serum hangt niet alleen af van de uitgebreidheid van de
celnecrose maar ook van de relatieve concentratie CK-MB
in de aangetaste vezels en van de bevloeiing van het
geÔnfarcteerde deel.
Het is belangrijk bij de diagnose van een hartinfarct
een vrij strikte timing aan te houden: CK-MB is het
eerste enzyme dat in meetbare hoeveelheden in het serum
vrijkomt na een infarct: het kan soms aangetoond worden
binnen de 3 tot 6 uur na het begin van de pijn, vůůr de
stijging van het totale CK. Het maximum wordt gewoonlijk
bereikt na 12 tot 24 uur, en men vindt opnieuw normale
waarden na 24 tot 48 uur. Het is dan ook belangrijk een
serumstaal te nemen bij opname, en controles te doen na
24 en 48 uur. Sommigen raden zelfs een bloedname om de
12 uur aan om een (eventueel kleine) stijging van CK-MB
niet te missen.
4.
Gamma Glutamyl Transferase (GGT of Gamma Glutamyl
Transpeptidase,GGTP)
Gamma glutamyl transferase is een enzyme dat in hoge
concentratie voorkomt in de lever en in mindere mate in de
nieren. Het heeft een grote, zij het niet volledige,
lever- en galwegenspecificiteit, en de bepaling is in de
eerste plaats te beschouwen als een levertest.
Eigenaardig genoeg dalen de GGT-concentraties bij
zwangerschap of inname van orale contraceptiva, en een
patiŽnte met leverpathologie kan dus in deze
omstandigheden normale GGT-waarden hebben.
Klinisch nut:
-
Leverziekten
GGT is gestegen bij 75 tot 90
% van de patiŽnten met bewezen lever-of
galwegenpathologie. De hoogste waarden komen voor waar
cholestase aanwezig is: cholestatische hepatitis,
extrahepatische galwegenafsluiting, levermetastasen. Bij
acute hepatitis stijgt GGT trager dan de andere enzymen,
tenzij er een cholestatische component aanwezig is. De
activiteit blijft ook het langst verhoogd. Bij actieve
cirrose (vooral bij primaire biliaire cirrose en
alcoholische cirrose) en bij chronische hepatitis worden
zeer hoge waarden gevonden.
GGT is zeer gevoelig aan alcoholgebruik, en kan dus
nuttig zijn bij de diagnose van chronische alcohol
abusus, of het houden van een onthoudingskuur (alcohol
stimuleert de produktie van GGT, en veroorzaakt
bovendien cholestatische leverletsels).
-
Andere aandoeningen
Acute pancreatitis en
acute opstoten van chronische pancreatitis doen GGT
stijgen.
Sommige nierziekten (zwaar nefrotisch syndroom,
rejecties bij niertransplanten, sommige maligne
niertumoren) veroorzaken verhoogde GGT waarden.
Hierbij enkele tabellen uit een artikel van J. Fevery
(cfr. referenties) over GGT.
-
|
"Klinisch nut" van serum GGTP
|
|
Als geÔsoleerde parameter
|
|
1 Indien normaal, kan een klinisch beduidend
leverlijden worden uitgesloten tenzij bij
zwangerschap en contraceptiva. Normaliseert
laattijdig na acute hepatitis (cfr.
thymol)
|
|
2 Hoogste waarden bij alcoholisch leverlijden,
cholestase (extrahepatisch
≥
intrahepatisch), levermetastasering.
|
|
3 In screening en follow-up van alcoholisme en
abstinentie (t/2 = 5 - 27 dagen).
|
|
In vergelijking met andere biochemische
parameters
|
|
1. GGTP
|
Alk. fosfatase
|
Bilirubine
|
|
|
zeer hoog
|
nl. of licht verhoogd
|
|
= alcohol
|
|
normaal
|
verhoogd
|
|
= skeletpathologie placentair,
zwangerschap
|
|
normaal
|
verhoogd
|
verhoogd
|
= kan toxische cholestase zijn door oestrogenen
of verwante steroÔden
|
|
verhoogd
|
normaal
|
laag normaal
|
= enzyme inductie
|
|
verhoogd
|
nl of licht verhoogd
|
normaal
|
= kan wijzen op levermeta's
|
|
minder hoog
|
hoog
|
zeer hoog
|
= bij sterke cholestase
|
|
2. GGTP
|
SGPT
|
kan wijzen op:
|
|
minder of gelijk gestegen dan
|
SGPT
|
acute hepatitis
|
|
iets meer gestegen dan
|
SGPT
|
chronische hepatitis
|
|
laag tot normaal
|
nog hoge SGPT
|
slechte evolutie (fulminante hepatitis)
|
|
3. Bij cirrose
|
|
|
GGTP/SGPT 30 ( 14)
|
verwijst naar alcohol (of p. biliaire) als
etiologie
|
|
GGTP/SGPT 4,5
|
post hepatitis
|
5. Fosfatasen
Alkalische fosfatasen
Alkalische fosfatasen komen voor in lever, beenderen,
darm, placenta. De normale serumactiviteit van ALP is
afkomstig van de lever en de beenderen. Bij kinderen en
adolescenten predomineert vooral de beender-ALP.
Intestinaal ALP komt soms in het serum na een maaltijd en
placentair ALP tijdens het derde trimester van de
zwangerschap. Verhoogde ALP-waarden bij nuchtere, niet
zwangere volwassenen zijn meestal terug te voeren tot
lever- of beenderletsels.
Klinisch nut:
-
beenderziekten: allerhande beenderziekten zoals
ziekte van Paget, hyperparathyroidie, beenmetastasen,
osteomalacie, osteo-sarcomen, hyperphosphatemie,
veroorzaken stijging van ALP.
-
leverziekten: vooral leverziekten gekenmerkt door
cholestase veroorzaken stijging van ALP (cfr. GGT):
obstructie van de ductus communis (stenen, striktuur,
tumoren); biliaire cirrose; "drug-induced"
cholestatisch icterus; virale hepatitis met cholestase;
infiltratie van de lever bij metastasen, sarcoidosis,
lymfomen, etc. Bij chronische actieve hepatitis of
levercongestie ziet men slechts zelden een stijging van
ALP.
-
andere ziekten: Pancreatitis en niertumoren
kunnen soms verhoogde ALP-waarden veroorzaken.
Bepaling van
iso-enzymen van alkalische fosfatasen
is mogelijk, maar heeft eerder beperkte indicaties.
Zure fosfatasen (ACP of Acid phosphatase)
Komt voornamelijk voor in de prostaat, in zeer geringe
mate in rode bloedcellen, bloedplaatjes, etc.
Duidelijk verhoogde waarden duiden praktisch altijd op
prostaatcarcinoom. Prostaathypertrofie en prostatitis
veroorzaken geen verandering van de enzym-spiegels.
Na prostaatmassage, of zelfs na onderzoek van de prostaat,
kan de ACP-waarde binnen enkele uren stijgen. Men raadt
dan ook aan bloed voor ACP af te nemen vůůr onderzoek van
de prostaat, of minstens 24 uur na het onderzoek.
Prostaatinfarct, transurethrale resectie van de prostaat
veroorzaken ook ACP-stijging.
Bij 19 % van patiŽnten met beendermetastasen, 2 % met
levermetastasen, 6 % met tumoren zonder lever- of
beenderinvasie, 10 % met primaire beenderkankers is de
ACP-activiteit verhoogd. Ook bij ziekte van Paget (21 %),
bij hyperparathyroidie (3/9) en sommige andere
beenderziekten ziet men de ACP-waarde stijgen.
De bepaling van
totale zure fosfatasen
wordt niet meer uitgevoerd. Dit onderzoek is vervangen door de bepaling van
tartraat-zure fosfaten en van
PSA (Prostaat Specifiek
Antigeen)
Meer uitleg over der verschillende testen en een
verduidelijking van de nomenclatuur vindt men in
"Laboratoriumonderzoeken bij prostaatkanker).
6.
Amylase
Amylase is een enzyme dat afgescheiden wordt door sommige
exocriene klieren: pancreas en speekselklieren. Veel
lagere activiteit komt voor in de ovaria, de dikke en de
dunne darm, spierweefsel.
Bij celbeschadiging komt niet-gesecreteerd enzyme in de
bloedbaan en bij opstoppen van de afvoerwegen zal enzyme
doorsijpelen naar het serum. De hoeveelheid enzyme die bij
celbeschadiging vrijkomt hangt af van het trauma, en van
de functionele toestand van de cellen.
Amylase wordt snel uit het serum verwijderd door de
nieren.
Klinisch nut:
-
Pancreasziekten:
stijging van serumamylasen
wijst meestal op pancreaslijden. Bij acute pancreatitis
stijgen de waarden binnen enkele uren.
Amylase is een zeer kleine molecule, en het wordt zeer
vlug door de nieren uit het bloed geklaard. De verhoogde
waarden dalen dan ook zeer vlug: binnen 48 tot 72 uur
kan de serumspiegel terug normaal zijn, terwijl de acute
ontsteking doorgaat. In dit geval kan het aantonen van
grote hoeveelheden amylase in de urine belangrijk
zijn.
Dalen van de amylase-spiegels kan dus wijzen op:
- vermindering van de ontsteking.
-
uitscheiding van het enzyme door de nieren
(verhoogde amylasurie).
-
functionele ineenstorting van de pancreas (er zijn
geen kliercellen meer over om het enzyme aan te
maken!).
Ook zonder pancreatitis kan spasme van de sfinkter van
Oddi (morfine!, radioŲpake substanties!) sterke stijging
van de amylase-concentraties veroorzaken.
-
Andere ziekten: bij
chemische irritatie van de pancreas kunnen de
waarden van amylase stijgen: geperforeerde maagzweer,
galblaas empyeem, darmobstructie, geruptureerde
extra-uteriene zwangerschap, peritonitis.
De stijging van de amylasemie is hier waarschijnlijk te
wijten aan pancreasirritatie of voorbijgaande
pancreasontsteking, met resorptie van de enzymen door de
gedilateerde bloedvaatjes.
-
Chronische pancreatitis veroorzaakt weinig
stijging, carcinoma van de pancreas veroorzaakt in
principe gťťn stijging van het enzyme.
-
Bij nierinsufficiŽntie wordt het enzyme niet
uitgescheiden en vindt men verhoogde waarden, zonder
pancreaslijden. De serumwaarden kunnnen stijgen tot 3 x
de normale waarden. Hogere stijging moet doen denken aan
pancreatitis. Bij kunstnierpatiŽnten is een stijging van
de waarden dan ook belangrijker dan ťťn enkele verhoogde
waarde.
-
Bij parotitis vinden we verhoogde amylase-waarden.
Er bestaat een abnormale vorm van het enzyme
(macro-amylasemie), waarbij amylasen gebonden zijn aan een
serumeiwit. Dit complex kan niet uitgescheiden worden door
de nieren. De bloedspiegels van amylasen zijn dan ook
verhoogd, de amylasurie is laag of normaal.
Het scheiden van amylase in verschillende isoŽnzymen is
mogelijk, maar wordt zelden of nooit uitgevoerd: de
differentiŽle diagnose tussen pancreas- en
speekselklierlijden is gewoonlijk niet moeilijk, en bij
twijfel kan het bepalen van de lipase activiteit hulp
bieden.
7.
Lipase
Lipase is een ander enzyme dat door de pancreas
afgescheiden wordt in het duodenum. Het komt in het bloed
na letsels van de pancreas (het enige orgaan dat lipase
bevat). Lipasen worden niet uitgescheiden door de nieren,
en de waarden blijven dan ook langer verhoogd.
Acute pancreatitis is de voornaamste oorzaak van
verhoogde lipasemie. De waarden lopen parallel met de
amylase activiteit in het begin van de ziekte, maar ze
blijven langer verhoogd. Lipase kan dus helpen bij
laattijdige diagnose van pancreatitis. Het is van weinig
nut bij chronische pancreatitis, bij chronische galwegen
aandoeningen, bij carcinoma van de pancreas. Ziekten van
de speekselklieren hebben geen invloed op de waarden van
de lipase.
Bij chronische nierinsufficiŽntie is de
lipase-activiteit in het serum verhoogd. Deze waarde
stijgt tijdens dialyse, waarschijnlijk door vetafbraak,
geinduceerd door heparine. Ook hier (zoals bij amylase) is
een stijging van de gevonden waarden een belangrijke
aanduiding voor pancreatitis, meer dan ťťn enkele
verhoogde waarde.
8.
Cholinesterase(CHE)
Twee soorten cholinesterase zijn gekend: "echte"
cholinesterase of acetyl-cholinesterase
en"pseudo"cholinesterase.
Acetylcholinesterase komt voor in alle weefsels, maar
vooral in de grijze hersenstof. Pseudocholinesterase wordt
gevormd in de lever en komt in alle weefsels voor. Zijn
juiste betekenis is niet gekend. Wij bepalen in ons
laboratorium pseudocholinesterase.
De bepaling van cholinesterase in serum is aangewezen als
test van de leverfunctie, als indicator van
vergiftiging door insekticiden en voor het opsporen
van patiŽnten met atypische vormen van dit enzyme.
Normale waarden gaan in ons laboratorium van 4,65 tot
10,65 U/ml, en deze waarden zijn bij ťťn persoon vrij
constant. Bij de geboorte zijn de waarden laag, maar ze
lopen snel op en bereiken de volwassen waarde rond de
tweede levensmaand.
Bepalen van cholinesterase is een
gevoelige leverfunctietest. Een daling van 10% bij
een bepaalde persoon wijst (in afwezigheid van
inhibitoren) op verminderde synthese in de lever. Bij
acute of langdurige chronische hepatitis ziet men 30 tot
50 % daling van de activiteit. Gevorderde cirrose of
levermetastasen veroorzaken een daling van 50 tot 70 % van
de normale activiteit. Bij milde vormen van chronische
hepatitis, bij lichte cirrose (zonder zware aantasting van
de leverfunctie) vindt men praktisch normale waarden. Ook
bij obstructieve icterus blijven de waarden normaal.
Vele organische insekticiden (Parathionį enz.)
inhiberen de cholinesterase activiteit. Vooral land- en
tuinbouwers zijn blootgesteld aan contact met deze giften.
Een asymptomatische vergiftiging (door contact met de
huid, de slijmvliezen of door inhalatie) kan reeds een
verlaging van 40 % van de enzymeactiviteit meebrengen. Bij
een daling van 80 % ziet men ernstige neuromusculaire
tekens. Bij zware vergiftigingen vindt men geen
enzymeactiviteit.
Succinylcholine (Suxamethoniumį, Myoplegineį) lijkt
erg op acetylcholine, en het wordt ook gehydroliseerd door
cholinesterase. PatiŽnten met een lage enzymeactiviteit,
of patiŽnten met atypische vormen van het enzyme, breken
dit medicament niet snel genoeg af, en dit kan aanleiding
geven tot verlengde apnee. Men raadt daarom aan de
cholinesterase activiteit te bepalen bij patiŽnten die
succinylcholine zullen toegediend krijgen. Verlaagde
waarden (verworven of aangeboren) vormen een
tegenindicatie voor de toediening van succinylcholine.
Atypische varianten van cholinesterase (aangeboren) kunnen
hiermee niŤt uitgesloten worden: hiervoor is de bepaling
van de enzymeactiviteit na inhibitie met dibucaine of
fluoride nodig. Deze bepaling kan voorlopig nog niet
uitgevoerd worden in ons laboratorium.
Verlaagde waarde van cholinesterase kan ook gevonden
worden bij acute infecties, longembolen, spierdystrofie,
myocard infarct, chronische nierinsufficiŽntie en
zwangerschap. Ook na heelkundige ingrepen kan er een
tijdelijke onderdrukking van de cholinesterase activiteit
zijn.
9. Aldolase (ALD)
Komt in alle cellen in mindere mate voor, maar toch
hoofdzakelijk in skelet en hartspier. Ook de lever bevat
matige hoeveelheden aldolase.
Stijging komt voor bij spieraandoeningen, leverziekten,
hartinfarct. Het biedt evenwel weinig bijkomende
informatie in de meeste gevallen.
Dit onderzoek wordt NIET meer uitgevoerd.
10.
Leucine Amino Peptidase (LAP)
LAP komt voor in pancreas, lever en duodenum. Zijn
bepaling kan soms nuttig zijn: het is zeer specifiek voor
hepato-biliaire aandoeningen.
|
|
 T N
A G C
T N
A G C
 C G
C G
























