|
De afbraak van glucose tot kooldioxide en water wordt koolhydraat
katabolisme genoemd en de oxidatieve decarboxylering is de
tweede stap in een proces dat uit vier stappen bestaat.
De eerste stap is de
glycolyse; de tweede stap is de oxidatieve decarboxylering ( pyruvate
dehydrogenase zet pyrodruivenzuur om in acetyl coŽnzym A ) de derde stap is de
citroenzuurcyclus
en de vierde stap is de
oxidatieve fosforylering.
Onder aŽrobe omstandigheden wordt pyrodruivenzuur oxidatief
gedecarboxyleerd tot acetylcoŽnzym A.
De term decarboxylering beschrijft een reactie waarbij een
carboxylgroep een carbonzuur verlaat in de vorm van
kooldioxide.
Op een aantal plaatsen in het metabolisme moet uit een verbinding
een carboxylaatgroep verwijderd worden die op een
ά-plaats ten opzichte van een carbonylfunctie zit. Deze
situatie wordt onder meer aangetroffen in pyrodruivenzuur, dat
omgezet moet worden in acetylcoŽnzym A en in de
citroenzuurcyclus, waar ά-ketoglutaraat omgezet moet worden
in succinaat.
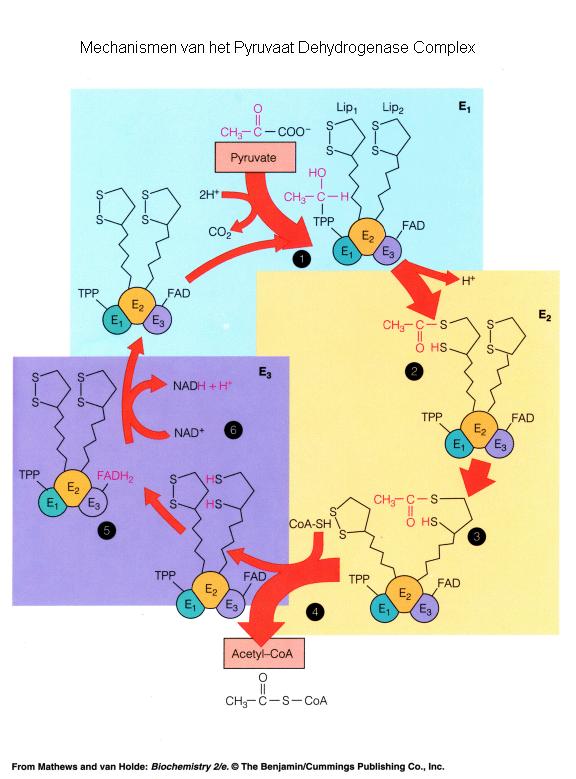
Het Pyruvaat Dehydrogenase Complex zet pyrodruivenzuur ( pyruvaat
) om in acetyl coŽnzym A. De enzymen van het PDH complex zijn
gelokaliseerd in het mitochondrion.
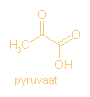
Pyrodruivenzuur: Engels: pyruvic acid; bruto formule :
C3H4O3 .
Pyrodruivenzuur heeft als zuurrest
pyruvaat.
Pyrodruivenzuur is het eenvoudigste
alpha-ketozuur
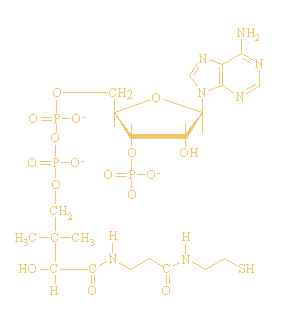
CoŽnzym A:
Brutoformule:
C21H36N7O16P3S
CoŽnzym A werd in 1945 door Fritz Albert Lipmann ontdekt , die
voor deze ontdekking in 1953 een Nobelprijs kreeg. (
autobiografie
)
CoŽnzym A is opgebouwd uit een cysteamine-eenheid, een
pantotheenzuurfragment en adenosinedifosfaat.
Het chemisch actieve gedeelte van dit coŽnzym is de thiolgroep,
vandaar dat het vaak wordt afgekort als CoA-SH.
Het lange CoA-gedeelte van CoA-SH dient om goede
bindingsinteracties aan te gaan met de enzymen die van dit coŽnzym
gebruik maken.
Het thiolaatanion is door zijn goede polariseerbaarheid een zeer
goed nucleofiel en bovendien een zeer goede vertrekkende groep.
Deze eigenschap maakt coŽnzym A bijzonder geschikt om op te treden
in omesteringsreacties.
Bekend is de werking van acetylcoŽnzym A in de biosynthese van
vetzuren. AcetylcoŽnzym A treedt op als algemeen reagens voor
acetyloverdracht op talrijke plaatsen in de cel. CoŽnzym A speelt
een centrale rol in het metabolisme van vetten, koolhydraten en
eiwitten waarvan de afbraak plaatsvindt via acetyl-CoA (
citroenzuurcyclus). CoA is ook betrokken bij de biosynthese van
vetzuren en bij acetyleringsreacties, zoals de vorming van
acetylcholine. De acetylering van CoA-SH tot acetyl-S-CoA door de
energieke verbinding acetylfosfaat wordt gekatalyseerd door het
enzym fosfotransacetylase.
CoŽnzym A
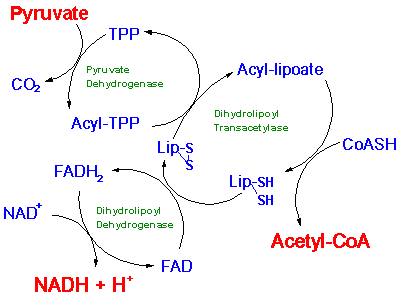
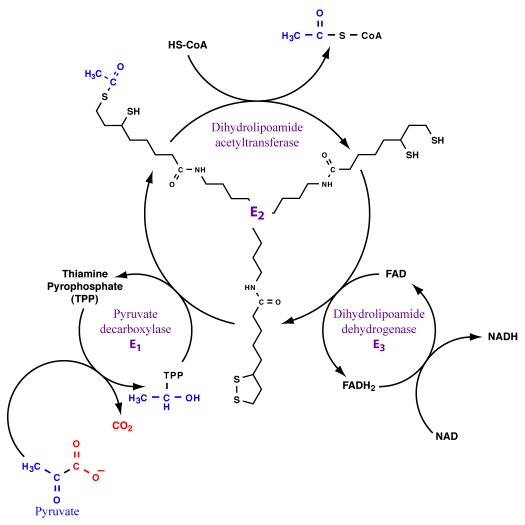
Het PDH complex bestaat uit meerdere kopieŽn van afzonderlijke
enzymen en heeft een moleculaire massa van meer dan 7.000.000.
Het bevat naast proteÔne X vijf verschillende
enzymactiviteiten op vijf verschillende subeenheden.
In mensen:
E1 wordt soms pyruvate dehydrogenase genoemd, wat
foutief is omdat E1 geen redoxreactie
katalyseert. Het E1 enzym zelf is een complexe
structuur, een heterotetrameer van 2 alpha- en 2 beta subeenheden.
De E1 alpha subeenheid speelt een sleutelrol in de
functie van het PDH complex omdat het de actieve zijde bevat.
Het complex vereist ook vijf verschillende coŽnzymen: CoŽnzym A,
Thiamine Pyrofosfaat, Lipoamide, Flavine Adenine Dinucleotide en
NAD+.
Het netto resultaat van de reacties in het PDH complex:
Pyruvate + CoA + NAD+
→ CO2 + Acetyl-CoA +
NADH + H+
1- pyruvate + TPP => 2-(alpha-hydroxyethyl)-TPP + CO2
2- 2-(alpha-hydroxyethyl)-TPP + lipoamide =>
S-acetyldihydrolipoamide + TPP
3- S-acetyldihydrolipoamide + CoA => acetyl-CoA +
dihydrolipoamide
4- dihydrolipoamide + FAD => lipoamide + FADH2 [pyruvate
dehydrogenase]
5- FADH2 + NAD+ => FAD + NADH + H+ [pyruvate dehydrogenase]
pyruvate dehydrogenase complex, S-acetyldihydrolipoamide linked
[mitochondrial matrix]
pyruvate dehydrogenase E1 complex [mitochondrial matrix]
pyruvate dehydrogenase complex [mitochondrial matrix]
pyruvate dehydrogenase E1 complex, 2-(alpha-hydroxylethyl)-TPP
linked [mitochondrial matrix]
pyruvate dehydrogenase complex, dihydrolipoamide linked
[mitochondrial matrix]
pyruvate dehydrogenase complex, FADH2 linked [mitochondrial
matrix]
pyruvate dehydrogenase complex, 2-(alpha-hydroxyethyl)-TPP
linked [mitochondrial matrix]
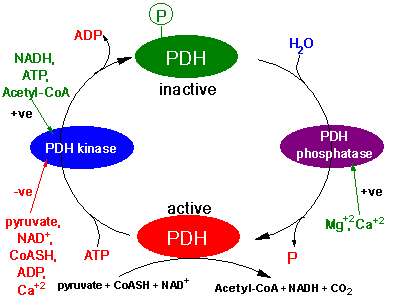
De activiteit van het PDH-complex wordt geregeld door de staat van
fosforylering en is het meest actief in de gedefosforyliseerde
staat. De fosforylering van PDH wordt gekatalyseerd door een
specifieke PDH Kinase.
De activiteit van PDH fosfatase is nog niet goed begrepen, maar
het is bekend dat Mg2+ en Ca2+ het enzym
activeren.
In vetweefsel laat insuline de activiteit van PDH toenemen en in
hartspieren laten catecholaminen de activiteit van PDH
toenemen.
Pyrodruivenzuur is een belangrijke stof in de celstofwisseling.
Het kan als voorloper dienen in vele biosynthese paden. Acetaat
( gedragen door CoA ) is ook een belangrijke stof in de
stofwisseling. De omzetting van pyruvaat naar acetaat is een
onomkeerbaar proces. Eenmaal omgezet kan acetaat niet meer
worden gebruikt om pyruvaat te synthetiseren. Pyruvaat kan
alleen worden verkregen uit de afbraak van grotere biomoleculen.
Op dit punt moet de cel beslissen:
Wordt het pyruvaat uit de glycolyse gebruikt om energie te
produceren of wordt het gebruikt voor andere biosynthese
reacties. Het PDH complex staat op dit kruispunt en controleert
de flux van pyruvaat naar de verschillende metabole paden.
Zie:
Pyruvate Metabolism
Een deficiŽntie in het PDH complex:
Het PDH complex zet pyrodruivenzuur om in acetyl CoA.
Acetyl CoA is een van de twee essentiŽle substraten die nodig is
voor de productie van citroenzuur in de citroenzuurcyclus. Een
deficiŽntie in dit enzymcomplex beperkt de productie van
citroenzuur. Omdat citroenzuur het eerste substraat in de
citroenzuurcyclus is kan deze cyclus niet verder verlopen. De
grootste hoeveelheid ATP die de cellen nodig hebben om de
homeostase te onderhouden, wordt geproduceerd door de oxidatie
van pyruvaat in de citroenzuurcyclus. Het gevolg van een
PDH-complex deficiŽntie is dus een tekort aan energie; met
name in het centrale zenuwstelsel.
Het overschot aan pyruvaat wat bij deze deficiŽntie ontstaat,
wordt omgezet in lactaat (melkzuur) en er ontstaat een
zuurvergiftiging ( acidose ) in het bloed; lactaatacidose.
Een deficiŽntie in het PDH complex wordt Pyruvaat Dehydrogenase
Complex DeficiŽntie genoemd.
De meest voorkomende vorm van Pyruvaat Dehydrogenase Complex
DeficiŽntie wordt veroorzaakt door mutaties in de X-chromosoom
gebonden E1 alpha gen; alle andere oorzaken worden
veroorzaakt door veranderingen in recessieve genen.
( PDH deficiŽntie kan ook worden veroorzaakt door mutaties in
andere subeenheden van het PDH complex, inclusief een vorm
(248600) die wordt veroorzaakt door mutaties in het E3 gen (DLD;
238331) op chromosoom 7q, en een vorm (245349) die wordt veroorzaakt door mutaties in het component X
gen (PDHX;
608769) op chromosoom 11p.
Mutaties in het PDHB gen (179060) die voor het E1-beta proteÔne codeert, of het DLAT gen
(608770) die voor het E2 proteÔne codeert kan ook PDH
deficiŽntie veroorzaken. Verder zijn verschillende
patiŽnten gerapporteerd met een deficiŽntie van het enzym
pyruvaat dehydrogenase phosphatase (608782) ).
Omdat een complete deficiŽntie van het PDH complex onverenigbaar
met het leven is, hebben alle kinderen met deze deficiŽntie een
bepaalde restactiviteit van dit enzym. Kinderen die geboren
worden met een restactiviteit van 15% of minder, overlijden in
het algemeen in het eerste levensjaar. Een restactiviteit van
25% of meer wordt geassocieerd met minder ernstige ziekte.
Pyruvate Dehydrogenase Complex Deficiency
OMIM:
312170
PYRUVATE DEHYDROGENASE COMPLEX, E1-ALPHA POLYPEPTIDE 1
OMIM:
Clinical Synopsis
e-Medicine:
Pyruvate Dehydrogenase Complex Deficiency

|
Hoofdmenu |
|