MitochondriŽn
|
|
|
|
|
MitochondriŽn
|
|
|
|
|
MitochondriŽn:Enkelvoud: mitochondrion ( Grieks van "mito" en "khůndrion" ).Ook wel: mitochondrium ( verlatijnste vorm), meervoud is dan mitochondriŽn of mitochondria. MitochondriŽn zijn celorganellen die de in koolhydraten en vetten aanwezige energie overdragen aan ATP en zo ter beschikking stellen van energievragende reacties in de cel. Het mitochondrion werd in 1886 voor het eerst gezien door Richard Altmann (Duits histoloog; 1852- Leipzig 1901), die dacht dat deze organellen intracellulaire parasieten waren. (Hij observeerde verschillende granula in het cytoplasma van diverse cellen. Hij dacht dat deze granula "elementaire organismen" konden zijn die in het cytoplasma leefden en noemde deze "bioblasts"). In 1897 vormde Carl Benda ( geboren op 30-12-1857 in Berlijn en overleden op 24-05-1932 in Turijn ) het woord mitochondrion uit " mito " ( schroefdraad) en " khůndrion " ( korreltje ), omdat deze organellen onder een lichtmicroscoop op schroefdraadvormige korreltjes lijken.
Korte historie:
Historie:Wetenschappers geloven dat ongeveer 1,5 miljard jaar geleden eukaryote cellen hun benodigde energie verkregen door een serie relatief inefficiŽnte reacties, waarbij geen zuurstof nodig was. Zuurstof, dat een afvalproduct van enkele van deze processen was, begon zich langzaam in de atmosfeer op te bouwen. Wetenschappers denken dat tijdens deze periode een primitieve eukaryote cel een primitieve bacterie heeft verslonden die het vermogen had gekregen zuurstof te gebruiken om grote hoeveelheden energie te produceren. Over miljoenen jaren begon er een symbiotische relatie te ontstaan tussen de cellen en vandaag de dag hebben alle cellen van planten en dieren organellen die de afstammelingen zijn van deze oorspronkelijke energie fabriekjes. In dierlijke cellen worden deze organellen mitochondriŽn genoemd. Planten hebben naast mitochondriŽn nog een tweede soort energie producerend organel, namelijk de chloroplast.
De endosymbiose theorie:
De intracellulaire organisatie van de levende cel , bestaande uit
gespecialiseerde organellen, maken complexe levensvormen mogelijk.
In het hierboven gestelde scenario was de aŽrobische bacterie die door de anaŽrobische bacterie was ingenomen , een proto mitochondrion. Met andere woorden , een organisme die het mogelijk maakte energie te produceren uit zuurstof. Symbiose , de relatie waarbij beide soorten een gezamenlijk voordeel behalen, zoals hierboven beschreven, wordt door sommigen beschouwd als het proces waarbij mitochondriŽn organellen werden in eukaryote cellen. Voordat we verder gaan graven in het bewijs voor deze theorie, moeten we eerst eens kijken naar de functie en structuur van de mitochondriŽn zoals we die vandaag de dag in onze cellen aantreffen. MitochondriŽn zijn eukaryote organellen die de oxidatieve ademhaling uitvoeren, de laatste stap in de cellulaire ademhaling. De oxidatieve ademhaling breekt pyruvaat af die in de glycolyse wordt gevormd waarbij kooldioxide wordt gevormd en produceert de grootste hoeveelheid ATP in de cellen. In eukaryote cellen is zuurstof nodig , omdat mitochondriŽn zuurstof gebruiken als de uiteindelijke elektronen acceptor in de elektronen transportketen, die tenslotte resulteert in een protonen gradiŽnt die de ATP synthese aandrijft. MitochondriŽn zijn in verschillende hoeveelheden aanwezig in verschillende eukaryote cellen . Cellen die veel energie nodig hebben zoals spierweefsel en de lever hebben verhoudingsgewijs meer mitochondriŽn dan bijvoorbeeld cellen die minder energie nodig hebben zoals botweefsel. Hoe is het mitochondrion opgebouwd? De kenmerken die we hier bekijken zijn de omvang van het mitochondrion, de membraan structuur, proteÔnen status en genetische informatie. MitochondriŽn zijn een van de grootste organellen in eukaryote cellen met een omvang van 0,3-1,0 micrometer tot 5-10 micrometer. Het heeft twee membranen waarvan de binnenste sterk geplooid is en cristae worden genoemd. De cristae zijn het startpunt voor enzymen en elektronendragers ( cytochromen ) die verantwoordelijk zijn voor de elektronen transport en de oxidatieve fosforylering. Vergeleken met alle andere organellen in de cel zijn mitochondriŽn uniek omdat ze hun eigen DNA bevatten, dat wil zeggen , gescheiden van het DNA in de celkern. Enkele proteÔnen van het mitochondrion worden door ribosomen in het mitochondrion geproduceerd , overeenkomstig zijn eigen onafhankelijk DNA. Wat is nu het bewijs die de endosymbiose theorie van het mitochondrion en de eukaryote cel ondersteunt? Enkele van de meest overtuigende bewijzen van de symbiose theorie werd hierboven reeds genoemd. Indien mitochondriŽn eens vrij levende bacteriŽn waren, bestaat de mogelijkheid dat er overblijfselen van hun vroegere conditie zijn overgebleven , ondanks dat ze vandaag de dag organellen zijn. Hieronder zullen we 6 punten bespreken:
Bijvoorbeeld : cycloheximide blokkeert eukaryote ribosomen door de uitwerking op de overdracht van tRNA, maar het heeft geen uitwerking op mitochondriŽn en bacteriŽn. Aan de ander kant zullen stoffen die de prokaryote synthese blokkeren, maar niet de eukaryote synthese, ook de mitochondriŽle synthese blokkeren, bijvoorbeeld erythromycine en tetracycline (Margulis, 1981, p. 217-218). De structurele overeenkomsten tussen mitochondriŽn en bacteriŽn zijn overweldigend , maar zeker niet afdoende. Velen betwijfelen de mogelijkheid van de symbiose theorie Ö. Dat er een vrij levende proto mitochondrion bestond ten tijde van de opbouw van zuurstof in de atmosfeer Ö, dat het op de een of andere manier een proto eukaryote cel binnendrongÖ., dat het een partner was in een symbiotische relatie die uiteindelijk resulteerde in een proto mitochondrion, daarbij zijn autonomie aan een grotere cel gevend en de weg vrij makend voor de eukaryote celÖ.. wordt dit te veel? Omdat evolutie in vele opzichten de historie is van verschillende chemische reacties van de formatie van de aarde tot de biochemische reacties in levende cellen , zullen we de mogelijkheid van de symbiose theorie eens bekijken. Ten eerste is het niet ondenkbaar dat vrij levende aŽrobische bacteriŽn die hoge energie moleculen zoals ATP produceren , een relatie aangaan waarbij die energie kan worden gebruikt. Ten tweede moet de productie van al die energie een enorme input van energie hebben vereist. Bijvoorbeeld een voldoende, beschikbare en efficiŽnte voedselbron. Ten derde, de komst van zuurstof in de atmosfeer, dat een giftig gas was voor de meerderheid van de organismen op dat moment op aarde, vereiste een nieuwe vorm van stofwisseling , gebaseerd op een nieuwe chemie. Ten slotte zouden proto eukaryote cellen die geen mogelijkheid hadden zuurstof in de atmosfeer om te zetten , moeilijk kunnen overleven. De basis voor de symbiose is duidelijk : anaŽrobische organismen leverden een constante bron van voedsel en fosfolipiden voor zowel de mitochondriŽle membranen als voor bacteriŽn. (Crawford and Marsh, 1995, p. 71-72). Als tegenprestatie stelde de energie die vrijkwam bij de ademhaling van zuurstof, de gast in staat te overleven en zich verder aan te passen aan de nieuwe condities op de aarde. De symbiose theorie wordt gestaafd door natuurlijke , geobserveerde voorbeelden van symbiotische relaties. Bepaalde zeevissen zijn in staat licht te emitteren vanwege de aanwezigheid van lichtgevende bacteriŽn in hun binnenste. Deze lichtgevende bacteriŽn leven ook vrijelijk in zeewater, maar geven dan geen licht. (Dyer and Obar, 1985, p. 127). Andere voorbeelden van symbiose zijn de relaties tussen verschillende schimmels en cyanobacteriŽn, algen en planten en bacteriŽn en zoogdieren. (Margulis, 1981, p. 165). Hoewel de transformatie van deze symbionten een enorme stap is , als deze al heeft plaatsgevonden, vond deze wel plaats over een periode van miljoenen jaren. Om de hierboven genoemde redenen kan men de theorie, dat mitochondriŽn evolueerden uit vrij levende aŽrobische bacteriŽn tot organellen in de eukaryote cel, niet negeren. De vraag blijft echter , hoe en uit wat konden proto mitochondriŽn evolueren naast blauw groene algen? Op welke manier drongen de proto mitochondriŽn de grotere aŽrobische cel binnen? Konden voorbeelden van vrij levende proto mitochondriŽn overleven? Bestaan zij of hun nakomelingen vandaag de dag nog? Zijn andere eukaryote organellen ook afgeleid van vrij levende organismen ? Vanwege de bewijzen kan men de symbiose theorie niet negeren. REFERENCE CITATIONS 1. Crawford, Michael and David Marsh, 1995. Nutrition and Evolution, p. 65-83. Keats Publishing, Inc., New Canaan, CT. 2. Dyer, Betsey Dexter and Robert Obar (editors), 1985. The Origin of Eukaryotic Cells, Van Nostrand Reinhold Company, Inc., NY. Papers by: a.) GoksÝyr, J., 1967, "Evolution of Eucaryotic Cells;" b.) Schwartz, R.M. and M.O. Dayhoff, 1978, "Origins of Prokaryotes, Eukaryotes, Mitochondria, and Chloroplasts;" c.) Raven, P.H., 1970, "A Multiple Origin for Plastids and Mitochondria;" d.) Doolittle, W.F., 1980, "Revolutionary Concepts in Evolutionary Cell Biology;" and e.) Smith, D.C., 1979, "From Extracellular to Intracellular: The Establishment of a Symbiosis." 3. Margulis, Lynn, 1981. Symbiosis in Cell Evolution, p. 206-227. W. H. Freeman and Company, San Francisco. 4. Prescott, L.M., J.P. Harley and D.A. Klein, 1996. Microbiology, third edition. Wm. C. Brown Publishers, Dubuque, IA
|
| Aerobisch | Anaerobisch | |
| 2 ATP gebruikt in de glycolyse | - 2 ATP | - 2 ATP |
| 4 ATP gevormd in de glycolyse | + 4 ATP | + 4 ATP |
| 2 NADH2 gevormd in de glycolyse via elektronentransportketen | + 6 ATP | |
| 8 NADH2 gevormd in de citroenzuurcyclus via de e.t. | + 24 ATP | |
| 2 GTP in de citroenzuurcyclus | + 2 ATP | |
| 2 FADH2 in de citroenzuurcyclus via de elektronentransportketen | + 4 ATP | |
| Totaal : | 38 ATP | 2 ATP |
Soms wordt een totaal van 36 ATP aangehouden, omdat bekend is dat
in eukaryote cellen het gereduceerde NAD, dat gevormd is door de
glycolyse in het cytoplasma, actief getransporteerd moet worden
over de mitochondriŽle membraan om beschikbaar te komen voor de
elektronentransportketen.
Het actieve transport over het membraan kost 1 ATP voor elk NADH
dat getransporteerd wordt. Wanneer men zo wil redeneren , moet men
ook het actieve transport van andere moleculen in ogenschouw
nemen. ( pyruvaat ? , fosfaat ? , Mg+ etc ).
Het juiste netto resultaat van ATP is onbekend , maar moet worden
beschouwd als minder dan 36.
MitochondriŽn zijn verbazingwekkend efficiŽnt bij de omzetting van
de chemische energie in suiker tot ATP. Een
verbrandingsmotor wordt al efficiŽnt beschouwd , als het 25
procent van de chemische energie die is opgeslagen in gasolie,
omzet in bewegingsenergie.
MitochondriŽn echter, zetten 54 procent van de energie die is
opgeslagen in suiker, om in ATP.
Hoewel het al lang werd vermoed werd pas in 1988 bewezen dat
defecten in mitochondriŽle genen konden leiden tot erfelijke
ziekten. In 1988 toonde Douglas Wallace van de Emory University
aan dat de zeldzame ziekte "
Leber's hereditary optic neuropathy
" werd veroorzaakt door mutaties in het mitochondriŽle
DNA.
MitochondriŽn oxideren korte- , midden - en grotendeels lange
keten vetzuren, terwijl
peroxisomen de
meeste zeer lang keten vetzuren en sommige lange keten vetzuren
oxideren.
MitochondriŽn gebruiken een acyl-CoA dehydrogenase om acyl-CoA om
te zetten tot enoyl-CoA. Dit enzym transporteert de elektronen
naar FAD en vervolgens naar de
elektronentransportketen. Peroxisomen gebruiken
een acyl-CoA oxidase welke uiteindelijk de elektronen naar
zuurstof transporteert, waarbij waterstofperoxide wordt gevormd
die weer door catalase wordt omgezet in water en zuurstof. Verder
worden de mitochondriŽle en peroxisomale enzymen gecodeerd door
verschillende genen.
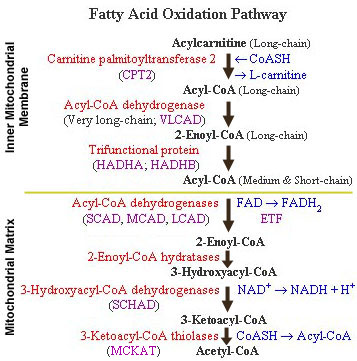
Het carnitine palmitoyltransferase systeem en de beta-oxidatie:
De hoofdbron voor de energie productie in de cel is de
mitochondriŽle beta-oxidatie van lang-keten vetzuren. Lang-keten
vetzuren kunnen niet direct de mitochondriŽle membranen passeren
en moeten eerst worden omgezet. Dit in tegenstelling tot de kort -
keten en middellange - keten vetzuren die door
diffusie de membranen kunnen passeren.
De oxidatie van lang-keten vetzuren in het mitochondrion
worden gekatalyseerd door de enzymen CPT I en CPT II . Samen met
acyl CoA synthetase en carnitine-acylcarnitine translocase
verzorgen zij het transport van vetzuren over de membranen van het
mitochondrion naar de mitochondriŽle matrix, waar deze vetzuren
uiteindelijk worden omgezet in energie in de vorm van
ATP.
Om de mitochondriŽle membranen te kunnen passeren , worden de
lang-keten vetzuren eerst geactiveerd door coŽnzym A en dan
verbonden met L-carnitine, een reactie die gekatalyseerd wordt
door het enzym carnitine palmitoyltransferase ( CPTase ).
Een deel van de CPTase activiteit ( CPT I ) is geassocieerd met de
buitenste mitochondriŽle membraan en katalyseert de vorming van
palmityl-carnitine. Palmityl-carnitine kan als carnitine ester de
buitenste membraan passeren.
Een andere activiteit van CPTase ( CPT II ) wordt geassocieerd met
de binnenste mitochondriŽle membraan . CPT II zet in het
mitochondrion palmityl-carnitine om in palmityl-CoA.
Tot slot initiŽren CPT II en carnitine-acylcarnitine translocase
de mitochondriŽle oxidatie van lang-keten vetzuren.
Het Carnitine Palmitoyltransferase ( CPT ) systeem, heeft
betrekking op twee verschillende proteÔnen, die gelokaliseerd zijn
op de buitenste - en binnenste mitochondriŽle
membranen.
CPT I wordt op de buitenste mitochondriŽle membraan gevonden en
CPT II wordt op de binnenste mitochondriŽle membraan gevonden.
CPT II wordt in alle cellen gevonden.
Van CPT I bestaan twee weefsel-specifieke isoformen, die L-CPT I
en M-CPT I worden genoemd.
L-CPT I wordt voornamelijk in de lever gevonden. M-CPT I wordt
voornamelijk in de spieren gevonden.
Het gen dat voor L-CPT I codeert, wordt CPT1A genoemd. Het
gen dat codeert voor M-CPT I , wordt CPT1B genoemd. Het gen
dat voor CPT II codeert, wordt CPT2 genoemd.
Het gen dat codeert voor CPT I is gelokaliseerd op chromosoom
11q13. Het gen dat codeert voor CPT II , is gelokaliseerd op
chromosoom 1p32.
De officiŽle naam voor het enzym carnitine palmitoyl transferase
is carnitine O-palmitoyltransferase.
EC nummer
2.3.1.21
Het enzym katalyseert de volgende reactie:
Palmitoyl-CoA + L-carnitine <=> CoA + L-palmitoylcarnitine
Stoornissen in dit systeem leiden tot de
carnitine palmitoyltransferase stoornissen.
De mitochondriŽle β-oxidatie spiraal:
De beta-oxidatie: de afbraak (dehydrogenering ) vindt plaats
tussen de alfa en bŤta koolstofatomen ( C2 en
C3 ) in een FAD gebonden reactie, die gekatalyseerd
wordt door acyl CoA dehydrogenase.
De producten van de beta-oxidatie zijn acetyl CoA,
FADH2, NADH en H+.
Acetyl CoA is acetyl coŽnzym A; FADH2 is de
gereduceerde vorm van flavine adenine dinucleotide en NADH is de
gereduceerde vorm van nicotinamide adenine dinucleotide.
De bŤtaoxidatie spiraal is een cyclus waarin acyl-CoA esters
steeds weer de cyclus doorlopen totdat ze volledig geoxideerd
zijn. Bij elke omgang in de cyclus wordt de ketenlengte met twee
koolstofatomen verkort .
Als voorbeeld kijken we eens naar Palmitoyl-CoA die een
ketenlengte van 16 koolstofatomen heeft.
De overall reactie is :
7 FAD + 7 NAD+ + 7 CoASH + H2O +
H(CH2CH2)7CH2CO-SCoA
> 8 CH3CO-SCoA + 7 FADH2 + 7 NADH + 7
H+
Palmitoyl-CoA maakt 7 omgangen in de bŤtaoxidatie spiraal door.
Bij elke omgang wordt de ketenlengte twee koolstofatomen korter,
waarna er uiteindelijk 8 delen met een ketenlengte van twee
koolstofatomen overblijven.
In de meeste weefsels zoals het hart en de spieren, worden deze 8
delen als acetyl-CoA in de
citroenzuur cyclus uiteindelijk omgezet in kooldioxide en water. In de lever
en de nieren wordt acetyl-CoA uit de β-oxidatie omgezet in
ketonen die daarna
voor de uiteindelijke oxidatie worden getransporteerd naar
bijvoorbeeld het brein en de spieren.
FADH2 , NADH en H+ worden geoxideerd in de
elektronen transportketen waarbij ATP wordt
gevormd.
Elke ronde van de Ŗ-oxidatie-spiraal wordt gereguleerd door
een reeks van enzymen, waarvan sommige specificiteit
bezitten voor de ketenlengte van het acyl-CoA vetzuur.
Voor een verzadigd acyl-CoA vetzuur (zoals bijvoorbeeld
palmitoyl-CoA ( C16 )) worden vier
enzymstappen gevolgd, te weten die van:
De ketenlengte-specifieke acyl-CoA dehydrogenase enzymen zijn
flavoproteÔnen; in het proces waarbij een dubbele binding gevormd
wordt tussen het a- en Ŗ- koolstofatoom van een
acyl-CoA-vetzuur (en waarbij dus het corresponderende
enoyl-CoA-vetzuur ontstaat), worden de vrijgekomen elektronen
afgegeven aan ETF (elekton transfer proteÔn) of ETF-dehydrogenase;
dit complex legt de link tussen Ŗ-oxidatie en ademhalingsketen.
De tweede reaktie in de Ŗ-oxidatie wordt gekatalyseerd door
enoyl-CoA hydratase (crotonase). Het enoyl-CoA-vetzuur
wordt hierbij gehydrateerd tot een L-Ŗ-hydroxyacyl-CoA-vetzuur.
Vervolgens katalyseert Ŗ-hydroxyacyl-CoA dehydrogenase (bestaande
uit 1 of meer enzymen) in een NAD+-afhankelijke
reaktie, oxidatie van de hydroxy-groep tot een ketogroep.
Bij de laatste reaktie, die gekatalyseerd wordt door
Ŗ-ketoacyl-CoA thiolase (ook weer bestaand uit 1 of meer
enzymen) wordt in aanwezigheid van gereduceerd CoA, de a-Ŗ binding
verbroken.
De twee produkten die bij deze reaktie
ontstaan zijn acetyl-CoA, en een acyl-CoA vetzuur dat 2
koolstofatomen korter is dan het oorspronkelijke substraat.
Zolang acyl-CoA-vetzuren een acetyl-CoA fragment af kunnen
splitsen, kunnen ze de Ŗ-oxidatie blijven doorlopen.
Er bestaan drie acyl-CoA dehydrogenase enzymen, die ieder een
verschillende ketenlengte-specificiteit bezitten; hoewel er
overlap bestaat tussen deze enzymen, kan gezegd worden dat in de
lever (V)LCAD ((Very) Long Chain Acyl-CoA Dehydrogenase) de eerste
reaktie in de Ŗ-oxidatie katalyseert voor acyl-CoA-vetzuren
met een ketenlengte van 18 tot 12 koolstofatomen.
MCAD (Medium Chain Acyl-CoA Dehydrogenase ) herkent
acyl-CoA-vetzuren met een ketenlengte variŽrend van 14 tot 4
koolstofatomen, en SCAD ( Short Chain Acyl-CoA Dehydrogenase )
herkent alleen vetzuurketens van 4en 6 koolstofatomen.
Vetzuren met een oneven ketenlengte worden ook in de bŤta-oxidatie
spiraal afgebroken tot er een molecuul met 3 koolstofatomen
overblijft. Dit molecuul ( propionyl CoA ) kan niet verder in de
bŤta-oxidatie spiraal worden afgebroken, maar wordt omgezet tot
succinyl CoA ( barnsteenzuur CoŽnzym A ) en wordt vervolgens
verder omgezet in de
citroenzuurcyclus.
Onverzadigde vetzuren:
Onverzadigde vetzuren zijn vetzuren die een of meer dubbele
bindingen in hun alkyl-keten hebben.
Meervoudig onverzadigde vetzuren met twee dubbele bindingen
hebben normaal gesproken een dubbele binding op C9 - C10 in de
alkyl-keten en een dubbele binding 3 C verder in de keten op
C12- C13.
De bŤtaoxidatie van deze vetzuren wordt doorlopen tot het punt
waarop de normale enzymen van de bŤtaoxidatie een dubbele
binding tegen komen. De enzymen van de bŤtaoxidatie zijn niet in
staat om op substraten te reageren die een dubbele binding
hebben tussen de bŤta en gamma C-atomen.
Om dit probleem op te lossen, verplaatst het enzym enoyl-CoA
isomerase de dubbele binding een C atoom verder naar het einde
van de alkyl-keten, waarna de bŤtaoxidatie weer een ronde verder
( en een deel van de tweede ) kan verlopen tot de volgende
dubbele binding wordt aangetroffen waarna het enzym 2,4
dienoyl-CoA reductase het vetzuur reduceert waarbij een
trans-3-dubbele binding ontstaat. Het enzym 3,2 enoyl-CoA
isomerase verplaatst deze dubbele binding verder naar het einde
van de vetzuurketen, waar het vetzuur als substraat voor de
normale bŤtaoxidatie enzymen kan dienen.
Historie:
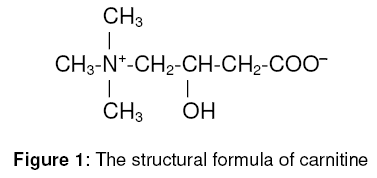
Carnitine ( 3-hydroxy-4-trimethyl aminoboterzuur :
C7H15NO3 ) is een kleine,
water oplosbare, quaternaire stikstof bevattende stof . Het wordt
in het lichaam in de lever, het brein en de nieren gesynthetiseerd
uit lysine en methionine ( met cofactoren zoals ascorbinezuur,
niacine , vitamine B6 en gereduceerd ijzer ).
Carnitine komt zowel in de L-vorm als in de D-vorm voor.
De L- vorm ( L-carnitine ) is de biologische actieve vorm.
Hoewel de mens in staat is carnitine uit lysine en methionine te
synthetiseren, moet tweederde van de benodigde carnitine uit het
voedsel gehaald worden.
Carnitine komt met name in rundvlees, schapenvlees en lamsvlees voor. Melk en kaas bevatten wat minder carnitine, terwijl fruit en groenten maar minieme hoeveelheden carnitine bevatten.
Carnitine is geen aminozuur , maar een vitamine-achtige
stof. Carnitine wordt niet afgebroken , maar wordt in de
urine uitgescheiden als vrije carnitine en veresterde vormen van
carnitine.
Carnitine functioneert in een driedelig enzymcomplex ( carnitine
acyltransferase I, carnitine translocase, en carnitine
acyltransferase II ) , die verantwoordelijk is voor het transport
van lange keten vetzuren over de binnenste mitochondriŽle
membraan.
Naast bovengenoemde sleutelfunctie speelt L-carnitine nog een rol
bij enkele andere metabole functies. Carnitine verbetert de
metabole flux in de
citroenzuurcyclus
en voorkomt de stapeling van lange keten Acyl CoA. Verder fungeert
L-carnitine als drager voor acyl-deeltjes ( verkort in de
peroxisomale beta-oxidatie ) van het peroxisoom naar het
mitochondrion, waar deze deeltjes verder geoxideerd kunnen
worden.
Carnitine is dus direct of indirect betrokken bij verschillende
metabole paden en de beschikbaarheid van carnitine is een
belangrijke factor die niet alleen de oxidatie van vetzuren en
ketonlichamen regelt, maar ook die van glucose en andere
aminozuren..
De Synthese van Carnitine in het lichaam:
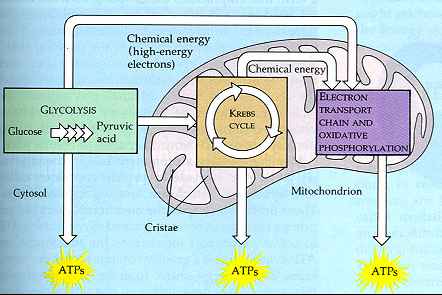
De elektronen transportketen.( de ademhalingsketen).
Bij de ademhaling wordt zuurstof opgenomen dat via de longen en
de bloedbaan getransporteerd wordt naar de mitochondriŽn in
de cel.
De functie van zuurstof is de verschillende
brandstofmoleculen te oxideren, waarbij energie vrijkomt
die voor tal van processen benut kan worden. Bij deze
oxidatiereacties worden uiteindelijk elektronen van een
substraat overgedragen op zuurstof. In biologische oxidaties
vindt deze elektronenoverdracht echter niet rechtstreeks plaats,
maar verloopt via een vaste serie reacties die bekend staat als
de elektronen transportketen of de ademhalingsketen.
Aan de elektronen transportketen neemt een aantal verbindingen deel die ieder voor zich goed een reversibele redoxreactie kunnen ondergaan. Iedere schakel in de keten reduceert een volgende schakel en wordt daarbij zelf geoxideerd.
Het NAD+/NADH-redoxkoppel heeft de meest negatieve reductie potentiaal en kan dus het gemakkelijkst elektronen doorgeven aan andere systemen.
Het elektronenverloop in de elektronen transportketen volgt de thermodynamisch strikt logische route van NADH ( twee elektronenoverdracht ) via de flavinen FMN of FAD naar coŽnzym Q. Dit coŽnzym draagt vervolgens de elektronen via vijf cytochromen ( b,c1,c,a en a3; ťťn-elektronprocessen ) over op zuurstof (vier-elektronenproces).
CoŽnzym Q is een knooppunt in de elektronen transportketen, want het sluist de elektronen van twee verschillende redoxpaden door naar zuurstof via het cytochromensysteem.
CoŽnzym Q is de enige verbinding in de elektronen transportketen die niet sterk gebonden zit aan een eiwit.
De isopreenketen aan coŽnzym Q maakt de verbinding zeer apolair, waardoor deze zich gemakkelijk in de apolaire omgeving van de mitochondriŽn kan bewegen en zodoende een mobiele schakel vormt tussen flavoproteÔnen en cytochromen.
Bij het elektronentransport vindt een geleidelijke verlaging van energie plaats. Een deel van de energie wordt opgeslagen in de vorm van ATP doordat het elektronentransport in de mitochondriŽn gekoppeld is aan de productie van ATP uit ADP en fosfaat.( ATP-adenosine tri-fosfaat;ADP-adenosine di-fosfaat ).
Dit proces wordt oxidatieve fosforylering genoemd.
Reacties:
NAD+ + H+ + 2 e Ř NADH
riboflavine + 2H+ + 2 e Ř dihydroriboflavine
coŽnzym Q10 + 2H+ + 2 e Ř dihydrocoŽnzym Q10
cytochroom c (Fe3+)+ e Ř cytochroom c (Fe2+)
cytochroom a3 (Fe3+) + e Ř cytochroom a3 (Fe2+)
O2 + 4H+ + 4 e Ř
2H2O
De oxidatieve fosforylering ( oxidative phosphorylation or OXPHOS).
Oxidatieve fosforylering :
Oxidatie is het proces waarbij elektronen worden afgestaan en fosforylering is het proces waarbij een fosfaatgroep wordt opgenomen.
Oxidatie vindt plaats in de volgende omkeerbare reactie :
NADH + ubiquinone <=> NAD+ + ubiquinol
Fosforylering vindt plaats in de volgende omkeerbare reactie :
ATP + H2O <=> ADP + fosfaat
De oxidatieve fosforylering is verantwoordelijk voor de meeste ATP (adenosine tri-fosfaat) die de cellen nodig hebben. ATP is de bron van cel-energie in alle levende wezens en niet alleen noodzakelijk om te leven, maar voor praktisch alle lichaamsfuncties, door de elektrische energie die daarvoor nodig is.
Het OXPHOS pad omvat meer dan 100 polypeptiden wiens genen of in het DNA van de celkernĖ of in het DNA van het mitochondrion gelokaliseerd zijn. De expressie van deze genen en de samenstelling van de vijf OXPHOS enzym complexen ( I t/m V) is een zeer geordend en gecoŲrdineerd proces.
Oxphos bestaat uit vijf enzym complexen. Deze enzymen zijn gelokaliseerd in het mitochondriŽle binnenste membraan en worden als volgt benoemd:
Complex I : NADH: ubiquinone oxidoreductase ( EC 1.6.5.3 )
Complex II : succinate:ubiquinone oxidoreductase ( EC 1.3.5.1 )
Complex III : ubiquinol: ferrocytochroom c oxidoreductase ( EC 1.10.2.2 )
Complex IV: ferrocytochroom c : oxygen oxidoreductase of cytochroom c oxidase ( EC 1.9.3.1 )
Compex V : H(+)-transporting two-sector ATPase ( EC 3.6.3.14 ) Formerly EC 3.6.1.34
Complex I en II collecteren de elektronen uit verschillende bronnen en geven ze af aan ubiquinone (coŽnzym Q10).
De elektronen bewegen zich dan door de complexen III en IV en reageren dan uiteindelijk met zuurstof.
Het is nu duidelijk dat ziekten kunnen ontstaan door mutaties in de genen van de celkern of in genen van het mitochondrion en er kunnen zelfs ziekten ontstaan door de fouten in systemen die de interactie tussen deze twee coŲrdineren.
Om deze redenen hebben OXPHOS ziekten een complexe reeks van erfelijkheid en hebben een breed spectrum aan klinische presentaties.
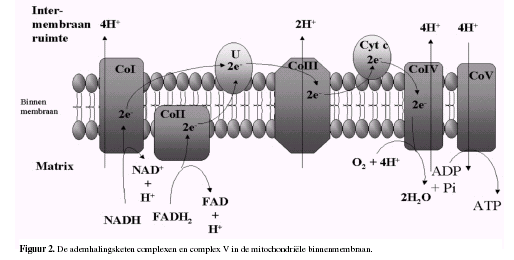
Complex I, III en IV overspannen de binnenste
mitochondriŽle membraan en zijn protonen pompen.
Complex II bevindt zich tussen complex I ( NADH: ubiquinone
oxidoreductase ) en Complex III ( ubiquinol: ferrocytochroom c
oxidoreductase ).
Complex II overspant de binnenste mitochondriŽle membraan niet,
maar bevindt zich aan de matrix-zijde van de binnenste
mitochondriŽle membraan en is het ingangspunt van elektronen
afkomstig van FADH2. Complex I is het ingangspunt
voor elektronen afkomstig van NADH.
Alle 4 genoemde enzymen bevatten prosthetische groepen die de
eigenlijke elektronendragers in de enzymen zijn.
In elk complex en ook van complex naar complex zijn
verschillende groepen betrokken bij de eigenlijke elektronen
overdracht. Deze groepen kunnen worden onderscheiden in:
ijzer-zwavel proteÔnen; haem; koper en flavinen. Allen dienen
als elektronendrager, echter elk enzymcomplex wordt geassocieerd
met bepaalde prostethetische groepen:
Complex I: FMN en Fe-S
Complex II: FAD en Fe-S
Complex III: Heme b-562, Heme b-566, Heme c1,
Fe-S
Complex IV: Heme a, Heme a3, CuA,
CuB


Copyright 1997. Thomas M. Terry, The University of
Connecticut.
Het schema hierboven illustreert een mitochondrion. Bekijk in de animatie hoe NADH H+ ionen en elektronen verplaatst in de elektronen transportketen.
Stap 1: Een Proton gradiŽnt wordt opgebouwd doordat NADH elektronen in de elektrontransportketen brengt..
Stap 2: Protonen (aangeduid door + lading) komen terug in de mitochondriŽle matrix door kanalen in het ATP synthase enzym complex. ATP wordt gesynthetiseerd uit ADP en fosfaat (Pi)
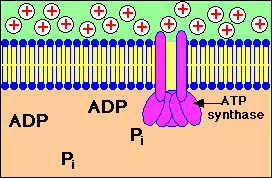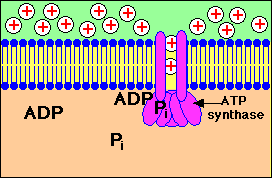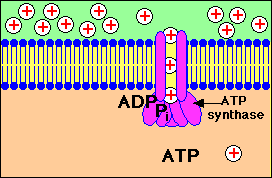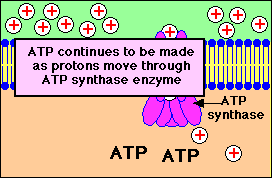
Bekijk in bovenstaande animatie hoe er een opbouw plaatsvindt
van H+ ionen in de ruimte tussen de binnenste en
buitenste mitochondriele membraam telkens wanneer NADH
geproduceerd wordt uit oxidatieve reacties.
protonen komen de matrix weer binnen door middel van het ATP
synthase complex waarna ATP geproduceerd wordt.
Protonen worden over het membraan getransporteerd; dat wil
zeggen: vanuit de matrix naar de ruimte tussen de binnenste en
de buitenste membraan.
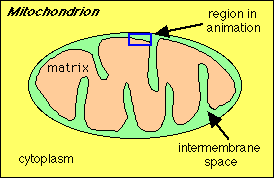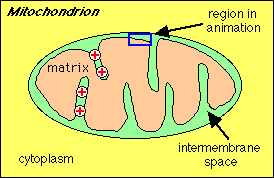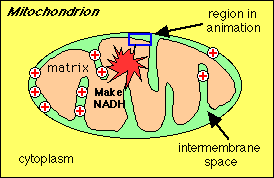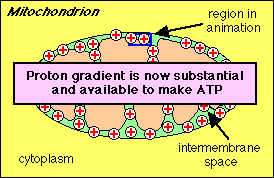
Terwijl NADH steeds meer H+ en elektronen in de
elektronen transportketen overbrengt, zal de proton gradiŽnt
toenemen, met een opbouw van H+ buiten de binnenste
mitochondriŽle membraan en OH- binnen de binnenste
mitochondriele membraan.
Er ontstaat een proton gradiŽnt.
ATP synthase
is een groot proteÔne complex met een proton kanaal
die de herintreding van protonen toestaat.
ATP synthese wordt aangedreven door de resulterende stroom van
protonen die door het membraan stromen:
ADP + Pi ---> ATP
Animaties:
ATP synthase
http://www.stolaf.edu/people/giannini/flashanimat/metabolism/atpsyn1.swf
This short animation illustrates the production of ATP by ATP
synthase.
ATP synthase mechanism
http://www.stolaf.edu/people/giannini/flashanimat/metabolism/atpsyn2.swf
This quick animation provides a look at the action of ATP
synthase.
Mitochondrial electron transport
http://www.stolaf.edu/people/giannini/flashanimat/metabolism/mido%20e%20transport.swf
Click here for a brief but clear animation demonstrating the
electron transport chain.
Algemeen.
De genen zijn een deel van de chromosomen die op hun beurt
gelokaliseerd zijn in de nucleus van elke cel.
De chromosomen zijn opgebouwd uit een verbinding die DNA wordt
genoemd.
De mitochondriŽn, die zich buiten de nucleus in het cytoplasma
van de cel bevinden, zijn een andere plaats waar DNA wordt
gevonden.
Dus ook de mitochondriŽn bevatten genen; alhoewel het
mitochondriŽle DNA ťťn lange streng genen is; en niet is
samengesteld uit chromosomen.
De hoeveelheden mitochondriŽn in elke cel kan variŽren van 1 tot
duizenden.
Al deze mitochondriŽn; en dus ook het DNA in de mitochondriŽn,
stammen af van een klein aantal mitochondriŽn die aanwezig waren
in de originele eicel op het moment van de conceptie. Het
sperma draagt niet bij aan de mitochondriŽn van de baby. Dus de
mitochondriŽn worden alleen geŽrfd van de moeder. (Zeer zeldzaam
voorkomend worden mitochondriŽn
van de vader
geŽrfd ).
Een abnormaliteit in ťťn van de genen in de mitochondriŽn kan
daardoor worden doorgegeven in de eicellen van de
moeder. Daar de meeste eicellen van de moeder dezelfde
mitochondriŽle mutatie bevatten, is het risico op een
volgend kind met een mitochondriŽleaandoening hoog.
Dit patroon van erfelijkheid wordt
maternale overerving genoemd. (maternaal = van de
moeder).
Veel aangeboren mitochondriŽle aandoeningen worden nucleus
defecten genoemd (Een fout in een gen in de kern van de cel);
met een overerving van: ofde vader, of de moeder of van zowel de
vader als de moeder. Dit patroon wordt
autosomaalrecessief erfelijk genoemd. Deze kunnen
dominant of recessief zijn. In dit geval is de kans op een
aandoening in het volgend kind 25%. Verder is er nog een
X-gebonden overerving; deze heeft betrekking op defecten
van het X-chromosoom. Nog een andere mogelijkheid is de kans dat
er tijdens de bevruchting een mutatie is opgetreden in een gen
en dat dit kind de eerste in een familie is die ziek
wordt.
De effecten van mutaties in de mitochondriŽle genen.
De eicel bevat veel mitochondriŽn en elk mitochondrion bevat
verschillende kopieŽn van de mitochondriŽle genen.
Wanneer een specifiek mitochondrieel gen in elk mitochondrion in
de eicel gemuteerd zou zijn en daarom de verkeerde
boodschap uit zou zenden,dan zou de breuk in de energie
productie zo ernstig zijn dat de vroege embryo dit niet zou
overleven.
( Anders gezegd: pas wanneer een
aanvankelijk laag percentage gemuteerde mtDNAs na een zeker aantal
celdelingen een bepaalde drempel overschrijdt, leidt dit (soms
vrij plotseling) tot problemen.
Omdat het aantal mtDNA kopieŽn per mitochondrion en per cel,
alsmede de behoefte aan oxidatieve fosforylering per weefsel
verschilt, heeft elk weefsel zijn eigen typische
drempelwaarde.
)
Dus; een persoon die geboren is met een erfelijke mitochondriŽle
ziekte moet twee typen mitochondriŽn van zijn of haar
moeder hebben geŽrfd: enkele die de correcte kopieŽn van het gen
bevatten en enkele die de gemuteerde en ziekmakende kopieŽn
van het gen bevatten.
In tegenstelling tot de meeste genetische ziekten waarbij de
mutatie in alle cellen van het lichaam wordt gezien, worden
mutaties van het mitochondriŽle DNA niet in alle cellen van het
lichaam gezien.
MitochondriŽn worden willekeurig verdeeld in de eicel wanneer
deze gevormd wordt in het ovarium. Daarom zal de samenstelling
van de mitochondriŽn in elke eicel variŽren van meest normaal
tot meest abnormaal.
Daarom zullen alle kinderen van deze moeder enige abnormale
genen erven, maar alleen symptomen ontwikkelen
wanneer de mitochondriŽn met het gemuteerde gen een zeker
kritisch niveau hebben bereikt met de interferentie van de
energie productie in het lichaam.
Het is dus niet te voorspellen in welke mate iemand ziek zal
worden en welke organen daar eventueelbetrokken bij
zijn.
Evenmin is het te voorspellen wat het verloop van de ziekte zal
zijn over een bepaalde tijd, daar men weinig
zal kunnen zeggen over de verdeling en de hoeveelheid van
de mitochondriŽn met het gemuteerde gen in het lichaam. De
gemuteerde mitochondriŽn kunnen gelokaliseerd zijn in de
skeletspieren, of in het hart ,of de nieren, of in
het brein of in de lever, enzovoort. Of in combinaties bij
bovenstaande , of in alle organen.
Dit maakt de mitochondriŽle aandoeningen zo complex.
Tot de mitochondriŽle ziekten behoren o.a. :
Stoornissen in de Carnitine cyclus:
defecten van de bŤta-oxidatie spiraal:
Meer informatie: VDAC Web Page
Meer informatie: Structure of the voltage dependent, ion selective channel (VDAC)
Voltage-Dependent Anion Channel 1; VDAC1
OMIM:
Voltage Dependent Anion Channel Deficiency ( VDAC
Deficiency )
Voltage-Dependent Anion Channel 2; VDAC2
OMIM:
Voltage-Dependent Anion Channel 2; VDAC2
( indeling van de ziektes naar de verschillende complexen )
( Indeling van de ziektes als verschillende syndromen )
Leber hereditary optic neuroretinopathy (LHON).
OMIM:
535000
OMIM:
Clinical Synopsis
GeneReviews:
Leber Hereditary Optic Neuropathy
Who named it?:
Theodor Karl Gustav von Leber
|
|